Содержание
- 2. Вспомним! Степень окисления – это условный заряд, который приобрел бы атом в молекуле, если бы все
- 3. 1. Степень окисления атомов в простых веществах равна нулю: 0 0 0 H2, Cl2, Na .
- 4. Алгебраическая сумма степеней окисления всех атомов в соединении всегда равна нулю: +1 -2 H2SO4 (+1)·2 +
- 5. В реакциях ионного обмена составные части веществ переходили в состав других веществ без изменений, степени окисления
- 6. Однако существует огромное множество реакций, в ходе которых меняются степени окисления элементов: 0 0 +2 -2
- 7. Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие
- 8. Элемент, отдающий электроны, называется восстановителем, а принимающий электроны - окислителем. Процесс отдачи электронов называется окислением, а
- 9. Эти процессы неразрывно связаны между собой, число принятых окислителем электронов должно быть равно числу отданных восстановителем
- 10. Чтобы составить схему о-в процесса, необходимо: 1. Определить степень окисления элементов. 2. Определить элементы, изменившие степень
- 11. 0 0 +3 -2 Al + S = Al2S3 Al0 - 3ē → Al+3 окисление S0
- 12. Mg + O2 = MgO 0 0 +2 -2 Mg0 - 2ē → Mg+2 окисление O20
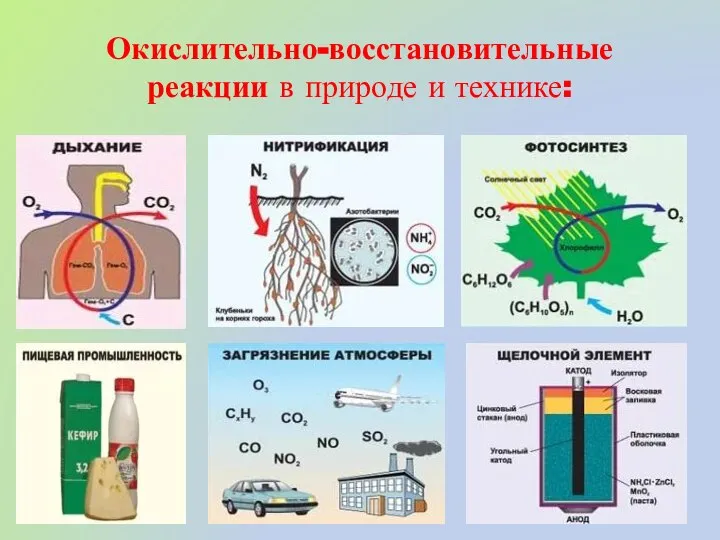
- 13. Окислительно-восстановительные реакции в природе и технике:
- 14. Задание 1. Определите степени окисления всех химических элементов, входящих в состав веществ: NaOH, MgCl2, K2CO3, AlCl3,
- 15. Задание 2. Расставьте коэффициенты методом электронного баланса в следующих уравнениях реакций: 1) HgO = Hg +
- 17. Скачать презентацию










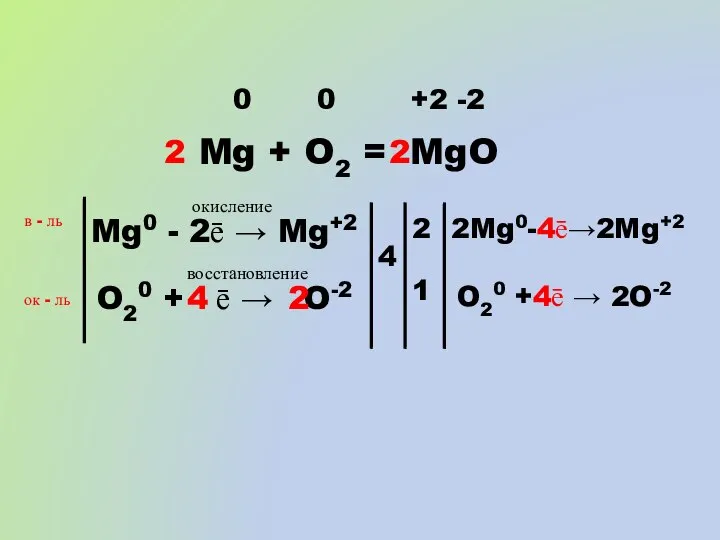


 03. Знакомство с лаб. оборудованием. Правила техники безопасности
03. Знакомство с лаб. оборудованием. Правила техники безопасности Силикатная промышленность
Силикатная промышленность Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич
Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич Презентация по Химии "Жиры животных" - скачать смотреть
Презентация по Химии "Жиры животных" - скачать смотреть  Алкілування ізобутану бутенами
Алкілування ізобутану бутенами Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой
Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой Строение электронных оболочек атомов
Строение электронных оболочек атомов Жиры
Жиры Обмен липидов
Обмен липидов Титан және оның қорытпалары
Титан және оның қорытпалары Основы химической термодинамики
Основы химической термодинамики Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Неорганические вещества клетки
Неорганические вещества клетки Презентация по Химии "Нефть" - скачать смотреть бесплатно
Презентация по Химии "Нефть" - скачать смотреть бесплатно Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно
Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно Общая характеристика металлов
Общая характеристика металлов Химическая кинетика. Лекция 9
Химическая кинетика. Лекция 9 Коллоидная химия. Введение
Коллоидная химия. Введение Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы The way to prepare gold clusters - Every atom makes a difference
The way to prepare gold clusters - Every atom makes a difference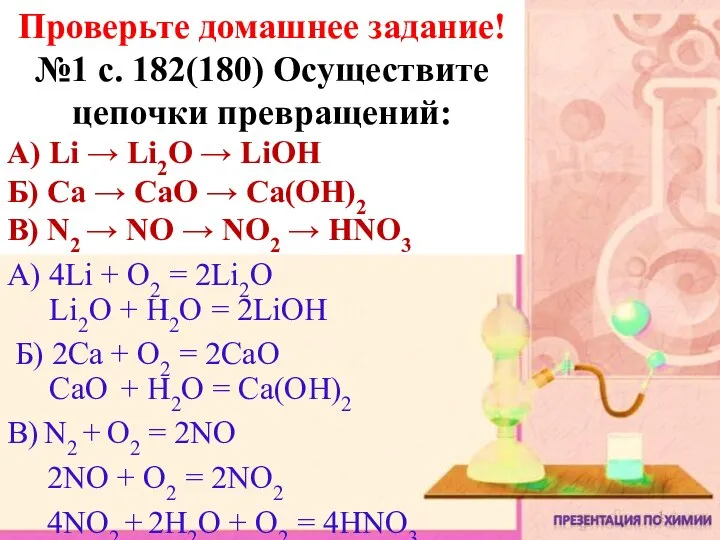 Реакции замещения
Реакции замещения Презентация по Химии "В мире веществ и реакций" - скачать смотреть
Презентация по Химии "В мире веществ и реакций" - скачать смотреть  Презентація на тему «Основи»
Презентація на тему «Основи»  Химия. Проверочная
Химия. Проверочная Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов  Алкены и Алкины
Алкены и Алкины Алкины
Алкины