Содержание
- 2. Відкриття Алюмінію: Вперше був отриманий датським фізиком Ерстедом в 1925 році. Назва була дана від латинського
- 3. Застосування: Застосовується в одній з галузей металургії - алюмотермії Алюмінати використовуються в багатьох галузях промисловості У
- 4. Електронна будова Алюміній, як і всі елементи, що знаходяться в III групі, головній підгрупі, має на
- 5. Фізичні властивості: Найпоширеніший метал в природі. Легкий Сріблясто-білий Пластичний Не має характерного металічного блиску (покритий тонкою
- 6. Хімічні властивості: Алюміній активний, але при нормальних умовах активність знижена наявністю міцної оксидної плівки, яка захищає
- 7. Взаємодіє з: Неметалами Киснем Лугами Водою Кислотами Оксидами металів
- 8. Солі алюмінію (алюмінати): Алюминат натрію використовують для отримання оксиду алюмінію в текстильній промисловості, як протраву для
- 9. Взаємодія з неметалами: Здатний до взаємодії під дією температури з сіркою, азотом і вуглецем. З галогенами
- 10. Взаємодія з лугами: 2Al + 2NaOH + 6H2O=2NaAl(OH)4 + 3H2 2NaOH + Al2O3 + 3H2O=2NaAl(OH)4 2Al
- 11. Взаємодія з водою: Якщо у відсутності повітря видалити з поверхні алюмінію оксидную плівку, то він активно
- 12. Взаємодія з кислотами: Концентровані сірчана і азотна кислоти пасивують алюміній (утворюється щільна оксидна плівка). При взаємодії
- 13. Взаємодія з киснем: Алюміній взаємодіє з киснем, утворюючи при цьому оксид алюмінію, що покриває метал тонкої
- 15. Скачать презентацию












 Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Получение и приминение этилена
Получение и приминение этилена Презентация по Химии "Почему золото блестит?" - скачать смотреть
Презентация по Химии "Почему золото блестит?" - скачать смотреть  Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. 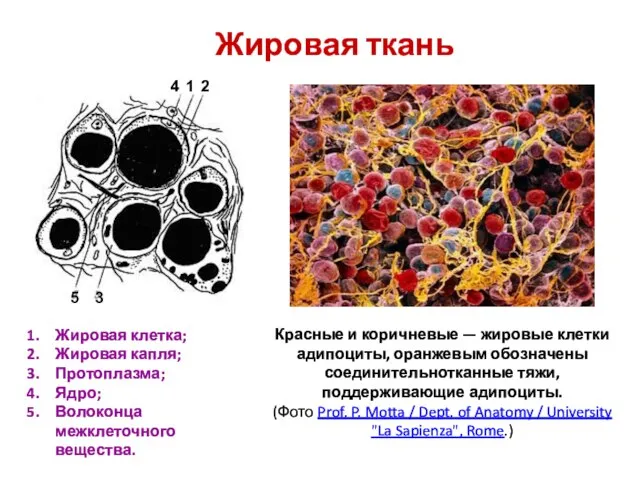 Жировая ткань
Жировая ткань Зависимость константы скорости химической реакции от температуры
Зависимость константы скорости химической реакции от температуры История микроскопа
История микроскопа  Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Химический элемент натрий
Химический элемент натрий Ковалентная химическая связь
Ковалентная химическая связь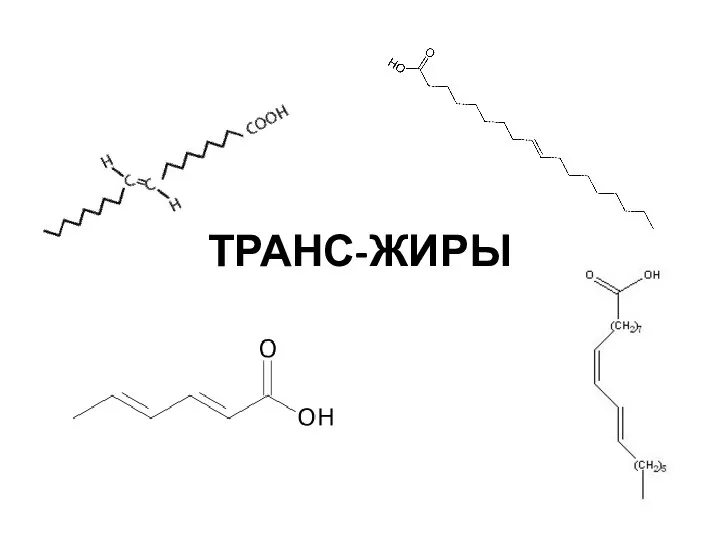 Транс-жиры
Транс-жиры Обмен липидов
Обмен липидов Метаболизм углеводов
Метаболизм углеводов Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В.
Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В. Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Водородная связь
Водородная связь Разделение смесей
Разделение смесей Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват Дисперсные системы и растворы
Дисперсные системы и растворы Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Соли. Названия и классификация солей
Соли. Названия и классификация солей