Содержание
- 2. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
- 3. Характеристика двойной связи (С ═ С) Вид гибридизации – Валентный угол – Длина связи С =
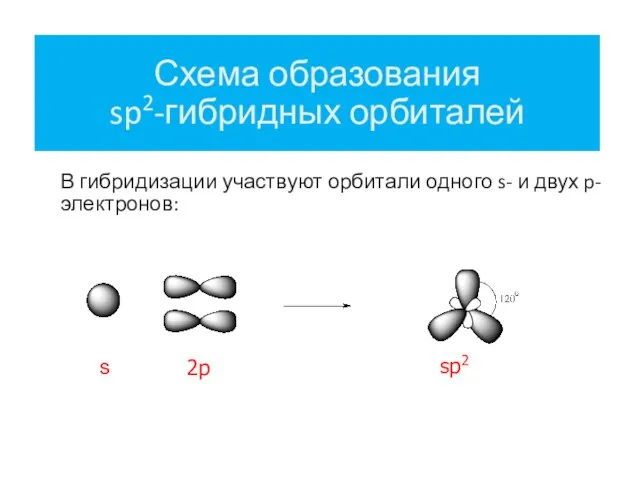
- 4. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов: s 2p sp2
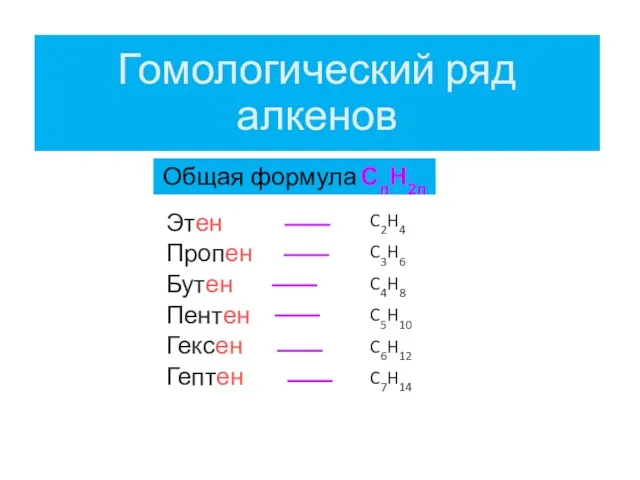
- 5. Гомологический ряд алкенов Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая
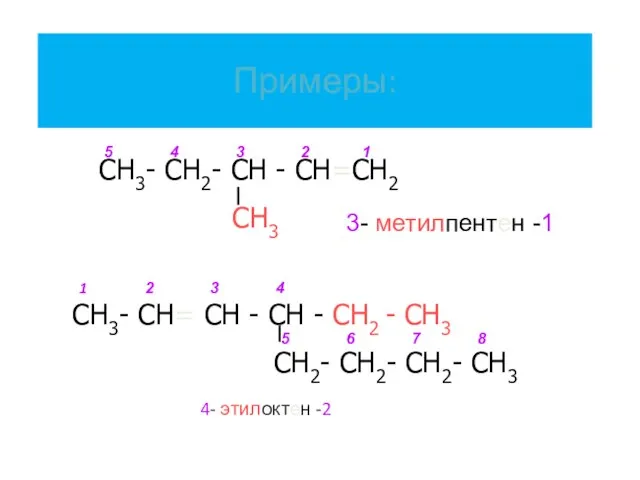
- 6. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
- 7. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С2– С4
- 8. Химические свойства алкенов По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества,
- 9. Типы химических реакций, которые характерны для алкенов Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 10. Реакции присоединения 1. Гидрирование. CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 11. Реакции присоединения 3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН2 = СН –
- 12. Гидрогалогенирование гомологов этилена Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной
- 13. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. Сокращённо уравнение
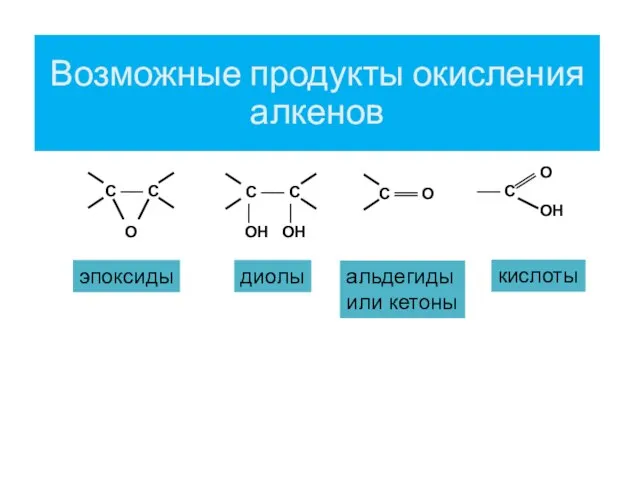
- 14. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
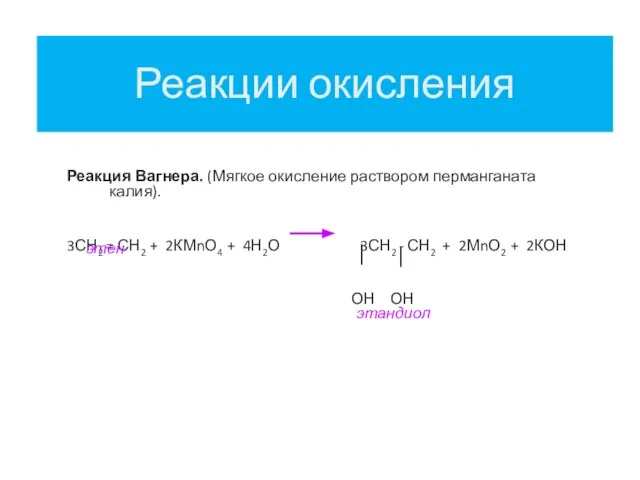
- 15. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
- 16. Реакции окисления 3. Каталитическое окисление. а) 2СН2 = СН2 + (О) 2СН3 – CОН этен уксусный
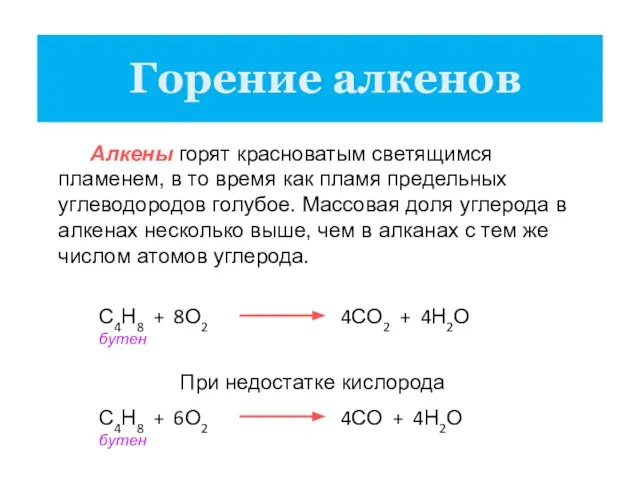
- 17. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
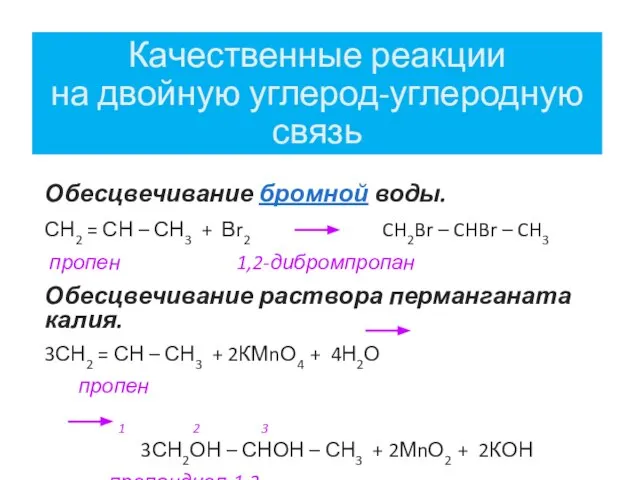
- 18. Качественные реакции на двойную углерод-углеродную связь Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2
- 19. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 21. Скачать презентацию











 Антисептические и дезинфицирующие средства
Антисептические и дезинфицирующие средства Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії
Структурні дослідження електрохімічних інтерфейсів методами малокутового розсіяння нейтронів та нейтронної рефлектометрії Основные классы органических соединений: циклические соединения
Основные классы органических соединений: циклические соединения Классификация веществ по характеру связи
Классификация веществ по характеру связи Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов железо
железо Э.М. Спиридонов. Эволюция минералов олова в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов олова в зоне гипергенеза Основные классы неорганических и органических соединений
Основные классы неорганических и органических соединений Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Липидтер
Липидтер Классификация моющих средств
Классификация моющих средств Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Неметаллы атомы и простые вещества кислород озон воздух. 9 класс
Неметаллы атомы и простые вещества кислород озон воздух. 9 класс Презентация по Химии "Органические вещества" - скачать смотреть
Презентация по Химии "Органические вещества" - скачать смотреть  Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Подготовительные курсы для абитуриентов химического факультета БГУ
Подготовительные курсы для абитуриентов химического факультета БГУ Классификация химических реакций по типу взаимодействия
Классификация химических реакций по типу взаимодействия Химизация сельского хозяйства и её направления
Химизация сельского хозяйства и её направления В гостях у Хозяйки Медной горы. Покровская сельская библиотека
В гостях у Хозяйки Медной горы. Покровская сельская библиотека Термический анализ
Термический анализ Виды топлива и их характеристика
Виды топлива и их характеристика Биохимические изменения компонентов молока в процессе переработки
Биохимические изменения компонентов молока в процессе переработки Анализ углеводов в пищевых продуктах
Анализ углеводов в пищевых продуктах Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Уравнение состояния идеального газа
Уравнение состояния идеального газа Влияние фтора на организм человека
Влияние фтора на организм человека