Обобщение и систематизация знаний по теме: Общая характеристика химических элементов и химических реакций
Содержание
- 2. Обобщение и систематизация знаний по теме: «Типы химических реакций» 1) Дайте характеристику реакции по всем признакам
- 3. Признаки классификации По числу и составу исходных веществ и продуктов реакции По тепловому эффекту По признаку
- 4. Обобщение и систематизация знаний по теме: «Типы химических реакций» Реакция разложения 2. Эндотермическая 3. Окислительно-восстановительная 4.
- 5. Обобщение и систематизация знаний по теме: «Типы химических реакций» 2)Расставьте степени окисления в ОВР, расставьте коэффициенты
- 6. Обобщение и систематизация знаний по теме: «Типы химических реакций» Al+C → Al4C3
- 7. Обобщение и систематизация знаний по теме: «Типы химических реакций» 3) В какую сторону сместиться равновесие данной
- 8. Правило. При увеличении температуры равновесие сместится в сторону эндотермической реакции и наоборот. Обобщение и систематизация знаний
- 9. Обобщение и систематизация знаний по теме: «Типы химических реакций» 4) Составьте молекулярное, полное и сокращенное ионное
- 10. Обобщение и систематизация знаний по теме: «Типы химических реакций» ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4
- 11. Обобщение и систематизация знаний по теме: «Типы химических реакций» 5) Определите тип гидролиза, среду в растворе
- 12. Обобщение и систематизация знаний по теме: «Типы химических реакций» Хлорид цинка – соль, образованная слабым основанием
- 13. Обобщение и систематизация знаний по теме: «Типы химических реакций» 6) Решите задачу по ТХУ. Определите количество
- 14. Обобщение и систематизация знаний по теме: «Типы химических реакций» n = m / M 1803 кДж
- 15. Обобщение и систематизация знаний по теме: «Типы химических реакций» 7) Найдите в списке вещества сильные электролиты
- 16. Обобщение и систематизация знаний по теме: «Типы химических реакций» H2SO4 -> 2H+ + SO42- HNO3 ->
- 18. Скачать презентацию















 Radiation dosimetry
Radiation dosimetry Биоэнергетика. Часть первая
Биоэнергетика. Часть первая Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Липиды. Классификация липидов
Липиды. Классификация липидов Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електро
Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електро Кислород
Кислород Фазовые диаграммы трехкомпонентных систем
Фазовые диаграммы трехкомпонентных систем Будова атома
Будова атома Переработка гидроминерального сырья
Переработка гидроминерального сырья Процессы нитрования
Процессы нитрования Карбонові кислоти. Насичені карбонові кислоти
Карбонові кислоти. Насичені карбонові кислоти Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Презентация Угольная кислота
Презентация Угольная кислота Дисахариды, моносахариды
Дисахариды, моносахариды «Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска
«Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска Атомдар мен молекулалар
Атомдар мен молекулалар Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста Железо
Железо Предельные углеводороды
Предельные углеводороды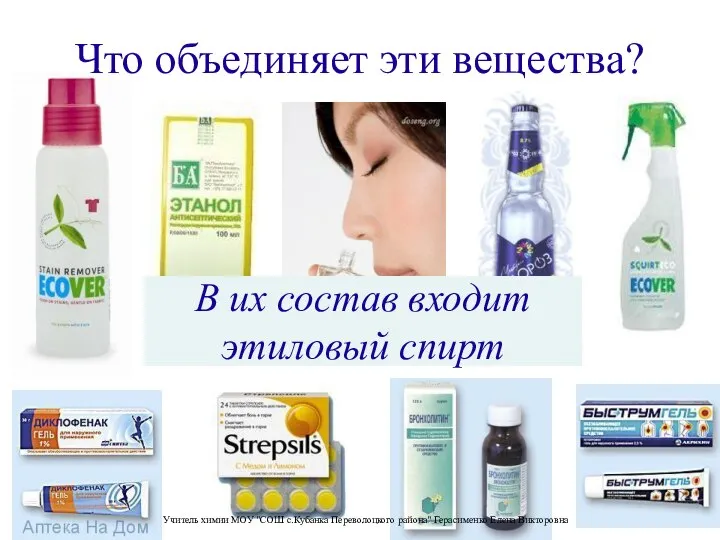 Что объединяет эти вещества?
Что объединяет эти вещества?  Презентация "Основания"
Презентация "Основания" Антибиотики. Действие антибиотиков
Антибиотики. Действие антибиотиков Важнейшие минералы
Важнейшие минералы Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Гліцерин (Гліцерол)
Гліцерин (Гліцерол) Классификация автомобильных масел
Классификация автомобильных масел Неорганические и органические основания.
Неорганические и органические основания.