1.Тест «ПРОВЕРЬ СЕБЯ» ( Отметить знаком «+»
номер положения, которое считается
верным)
Железо – это активный щелочной металл.
Железо легко куется.
Железо входит в состав сплава бронзы.
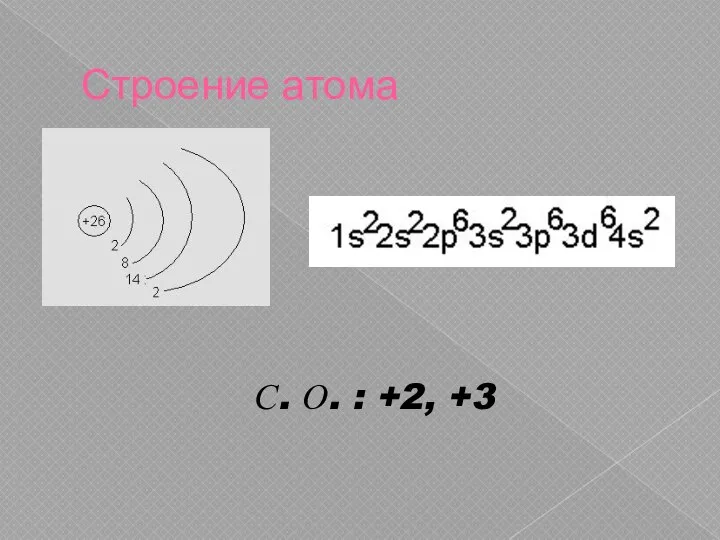
На внешнем энергетическом уровне атома железа 2 электрона.
Железо взаимодействует с разбавленными кислотами.
С галогенами образует соединения со степенью окисления +2.
Железо не взаимодействует с кислородом.
Железо можно получить путем электролиза расплава его соли.
Железо – это металл серебристо-белого цвета.
Железо не обладает способностью намагничиваться.
Атомы железа проявляют окислительные свойства.
На внешнем энергетическом уровне атома железа 1 электрон.
Железо вытесняет медь из растворов ее солей.
С галогенами образует соединения со степенью окисления +3.
С раствором серной кислоты образует сульфат железа (II).
Железо не подвергается коррозии.
Вариант 1.
Вариант 2.













 Виды топлива и их характеристика
Виды топлива и их характеристика Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева (урок 1 - 2)
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева (урок 1 - 2) Сера. Свойства серы
Сера. Свойства серы Азотная кислота и ее соли - нитраты
Азотная кислота и ее соли - нитраты Презентация по Химии "Разрешите вам представить - иод" - скачать смотреть
Презентация по Химии "Разрешите вам представить - иод" - скачать смотреть  Процессы горения. Способы сжигания топлива. Горелочные устройства
Процессы горения. Способы сжигания топлива. Горелочные устройства Э.М. Спиридонов. Эволюция минералов ртути в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов ртути в зоне гипергенеза Значення хімічних процесів у природі
Значення хімічних процесів у природі Характеристика шкідливих хімічних речовин, забруднювачів атмосфери
Характеристика шкідливих хімічних речовин, забруднювачів атмосфери Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Химия и пища
Химия и пища Углеводы. Характерные получения и химические свойства углеводородов
Углеводы. Характерные получения и химические свойства углеводородов Общее понятие о липидах. Переваривание и всасывание липидов
Общее понятие о липидах. Переваривание и всасывание липидов Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Удивительная вода и ее свойства
Удивительная вода и ее свойства Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Презентація на тему: «КАВА»
Презентація на тему: «КАВА»  Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Соединения галогенов
Соединения галогенов Многоатомные спирты
Многоатомные спирты Валентность химических элементов
Валентность химических элементов Пиролиз
Пиролиз Зелёная химия
Зелёная химия Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Принципы создания полимерных конструкционных нанокомпозитов
Принципы создания полимерных конструкционных нанокомпозитов Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Презентация Угольная кислота
Презентация Угольная кислота