Содержание
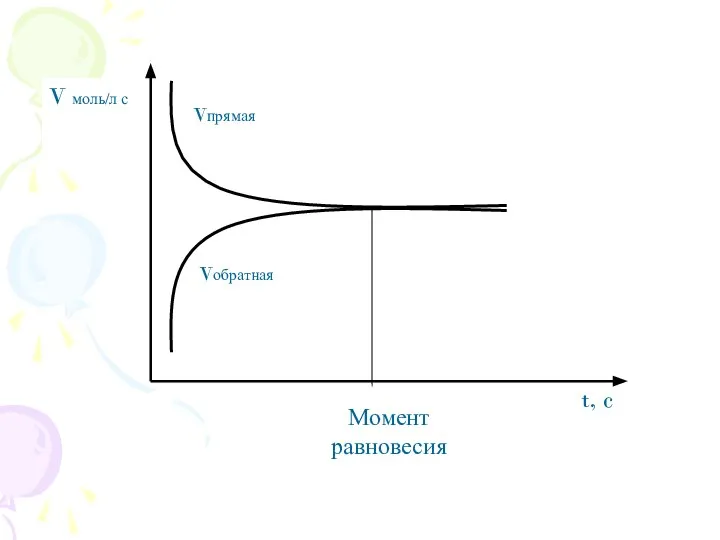
- 2. Углубить и обобщить знания о состоянии химического равновесия, условиях его смещения. Дать понятие о константе равновесия.
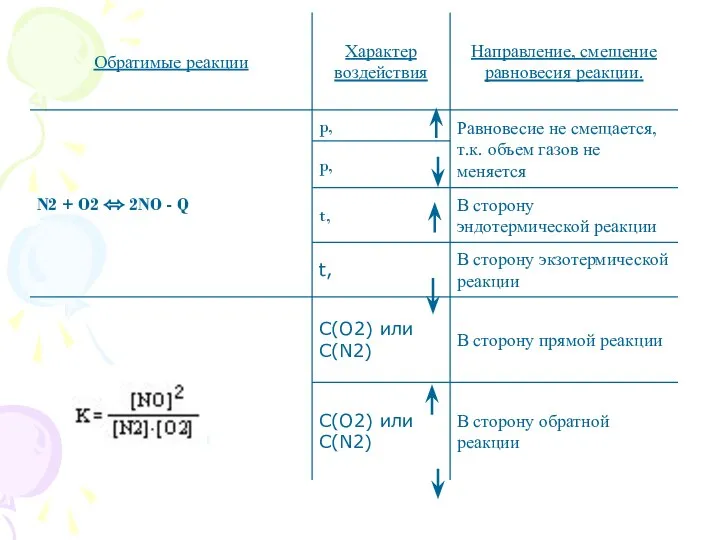
- 3. Какие из химических реакций являются обратимыми? 1. NaOH + HCl ? NaCl + H2O 2. N2
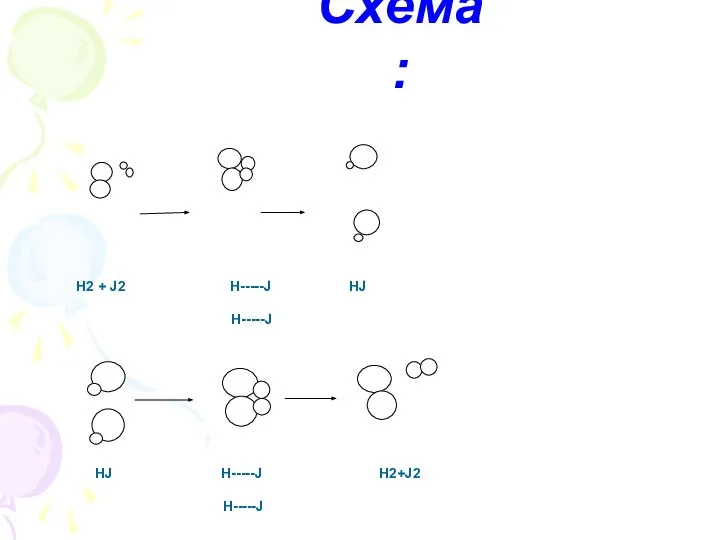
- 4. Схема: Н2 + J2 Н-----J HJ Н-----J HJ Н-----J H2+J2 Н-----J
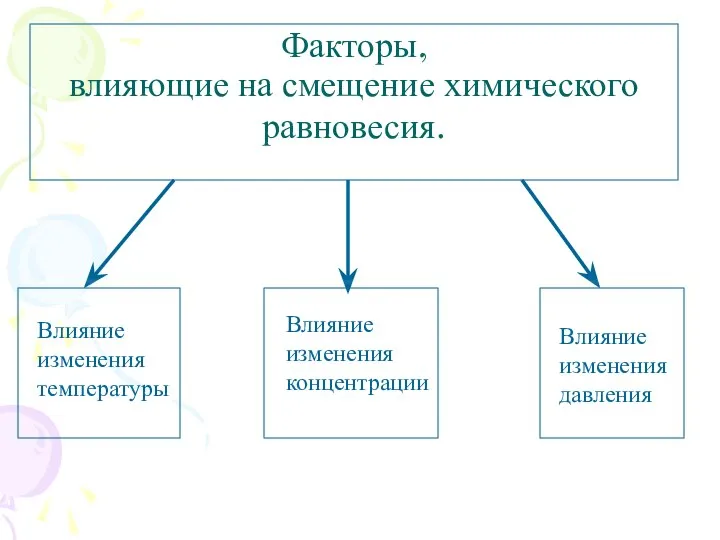
- 6. Факторы, влияющие на смещение химического равновесия.
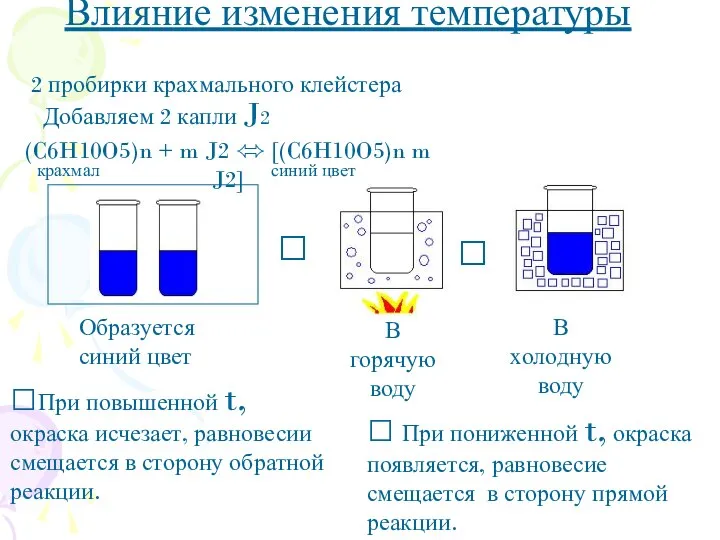
- 7. ? ? Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 ?При повышенной t,
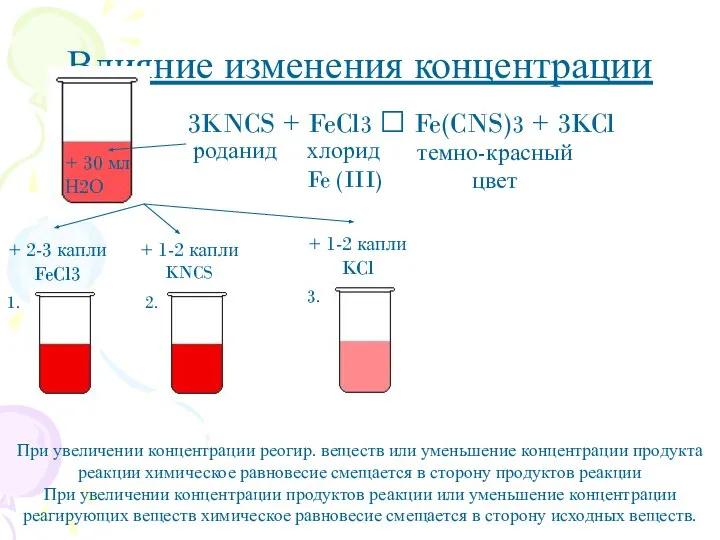
- 8. Влияние изменения концентрации + 2-3 капли FeCl3 + 1-2 капли KNCS + 1-2 капли KCl При
- 9. Влияние изменения давления 2NO2 ⬄ N2O4 + Q При расширении цвет газа стал темно-бурым, а равновесие
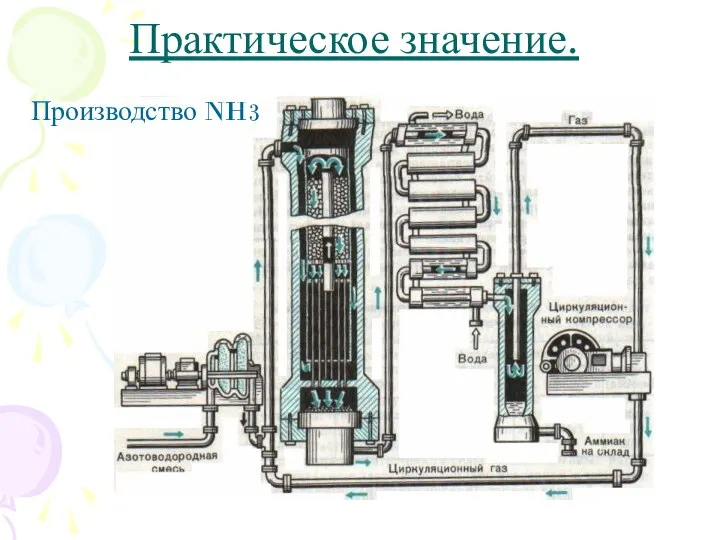
- 10. Практическое значение. Производство NH3
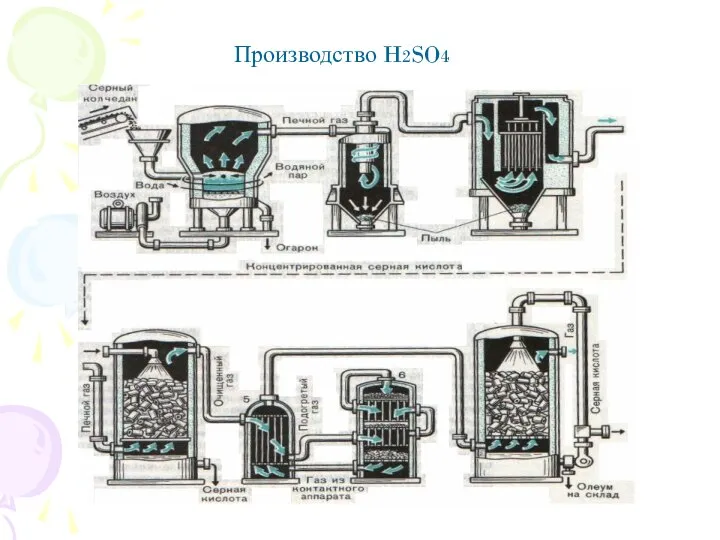
- 11. Производство H2SO4
- 12. Производство HNO3
- 13. 1.Смещение химического равновесия обеспечивает высокий выход желаемого продукта. 2. Открывает путь к управлению химическими реакциями.
- 16. Скачать презентацию





 Коллигативные свойства растворов. Осмос. Осмотическое давление
Коллигативные свойства растворов. Осмос. Осмотическое давление Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове
Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове  Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) Мыло и мыловарение
Мыло и мыловарение Харчові добавки
Харчові добавки  Органическая химия
Органическая химия Химический состав клетки
Химический состав клетки Целлюлоза Выполнила студентка 11 группы Сыровацкая Лилия
Целлюлоза Выполнила студентка 11 группы Сыровацкая Лилия  Угольная кислота и ее соли
Угольная кислота и ее соли Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Презентация по Химии "Галогени" - скачать смотреть бесплатно
Презентация по Химии "Галогени" - скачать смотреть бесплатно Таблица «Периодическая система Д.И.Менделеева»
Таблица «Периодическая система Д.И.Менделеева» Строение и свойства белков
Строение и свойства белков Водородная связь
Водородная связь Этот удивительный Мир симметрии - презентация_
Этот удивительный Мир симметрии - презентация_ Розроблення моделі легування квантової точки InAs в матриці GaAs в хлоридній системі
Розроблення моделі легування квантової точки InAs в матриці GaAs в хлоридній системі Фазовые равновесия «раствор-пар» в двухкомпонентных системах из двух летучих жидкостей
Фазовые равновесия «раствор-пар» в двухкомпонентных системах из двух летучих жидкостей Кислород. Историческая справка
Кислород. Историческая справка Презентация Изомерия алкенов.
Презентация Изомерия алкенов.  Биологически активные добавки
Биологически активные добавки Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Другого ничего в природе нет Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Все – от песчинок малых до план
Другого ничего в природе нет Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Все – от песчинок малых до план Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23)
Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23) Эластомеры (резины)
Эластомеры (резины) Оксиды углерода
Оксиды углерода Як захистити себе від нітратів
Як захистити себе від нітратів  Катализ. Влияние катализатора на скорость химической реакции
Катализ. Влияние катализатора на скорость химической реакции Горение. Подводный факел
Горение. Подводный факел