Содержание
- 2. Коллигативные свойства растворов Коллигативными (коллективными) свойствами растворов называют такие свойства, которые не зависят от природы растворенного
- 3. К коллигативным свойствам относятся: понижение давления насыщенного пара над раствором по сравнению с чистым растворителем; повышение
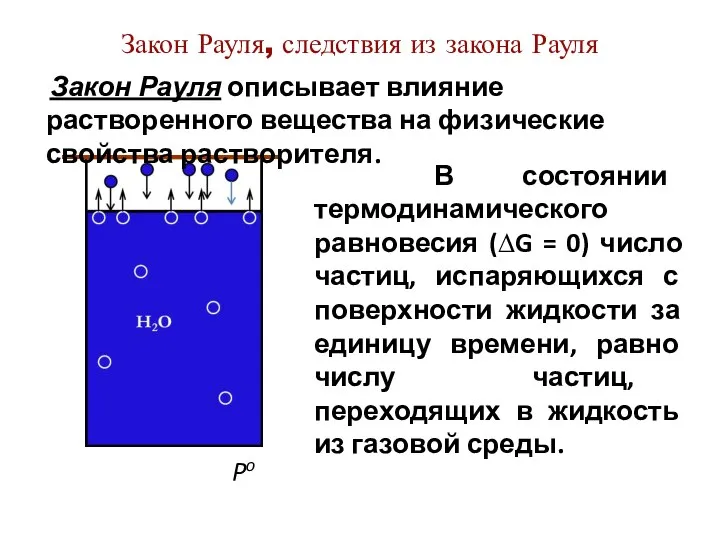
- 4. Закон Рауля, следствия из закона Рауля Po В состоянии термодинамического равновесия (∆G = 0) число частиц,
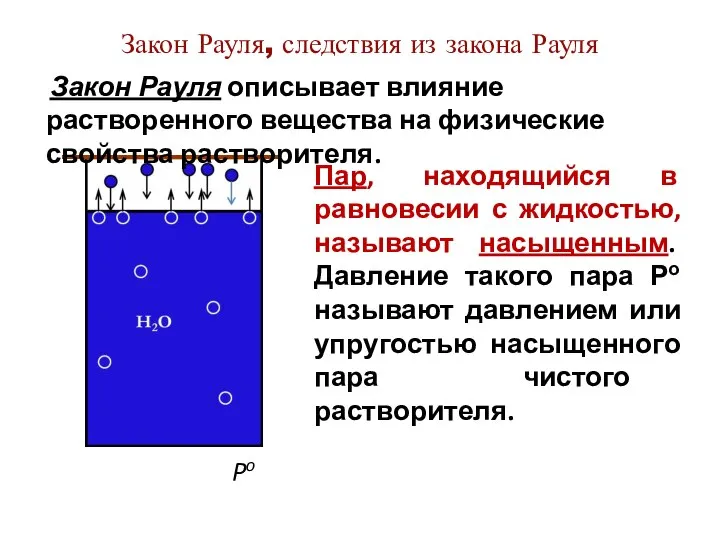
- 5. Закон Рауля, следствия из закона Рауля Po Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление
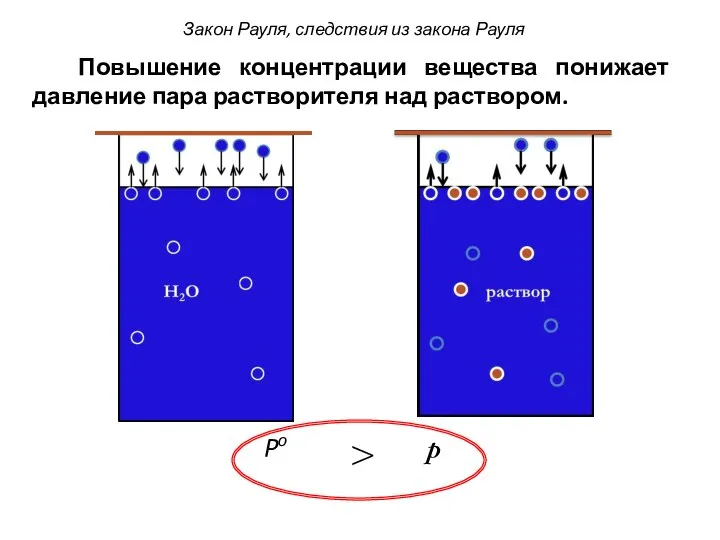
- 6. Po p > Повышение концентрации вещества понижает давление пара растворителя над раствором. Закон Рауля, следствия из
- 7. Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором нелетучего электролита равно мольной (молярной) доле
- 8. Математическое выражение закона: , где Po – давление пара над чистым растворителем, Па; Р – давление
- 9. Для растворов электролитов в уравнение Рауля вводится изотонический коэффициент Вант-Гоффа i. , где Ni – число
- 10. Величина изотонического коэффициента зависит от степени диссоциации α (в долях от единицы) и числа дочерних частиц
- 11. Следствия из закона Рауля 1. Повышение температуры кипения разбавленных растворов неэлектролитов по сравнению с чистым растворителем
- 12. 2. Понижение температуры замерзания разбавленных растворов неэлектролитов по сравнению с чистым растворителем прямо пропорционально моляльной концентрации
- 13. Эбуллиометрические и криоскопические константы зависят только от природы растворителя и не зависят от природы растворенного вещества
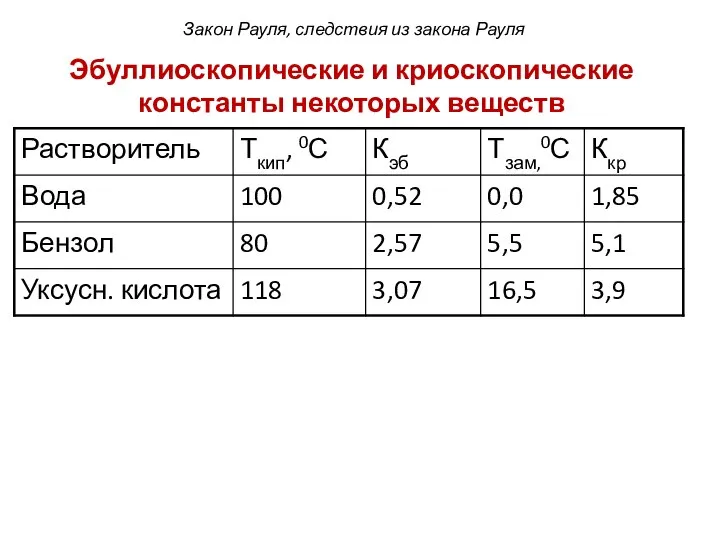
- 14. Эбуллиоскопические и криоскопические константы некоторых веществ Закон Рауля, следствия из закона Рауля
- 15. Следствия из закона Рауля применяют в физико-химических методах исследования. Эбуллиоскопия (от лат. ebulio – вскипаю и
- 16. Криоскопия (от греч. κρύο – холод и греч. σκοπέω смотрю) – физико-химический метод исследования, основанный на
- 17. Автоматический криоскопический осмометр измеряет тотальную осмолярность водных растворов. Удобен для использования в палатах интенсивной терапии и
- 18. Эти методы используются для определения: значения криоскопической константы для веществ с известной молекулярной массой; моляльной концентрации
- 19. Молярные массы (г ∙ моль-1) растворенных веществ-неэлектролитов рассчитываются по формулам: Для растворов электролитов с учетом i:
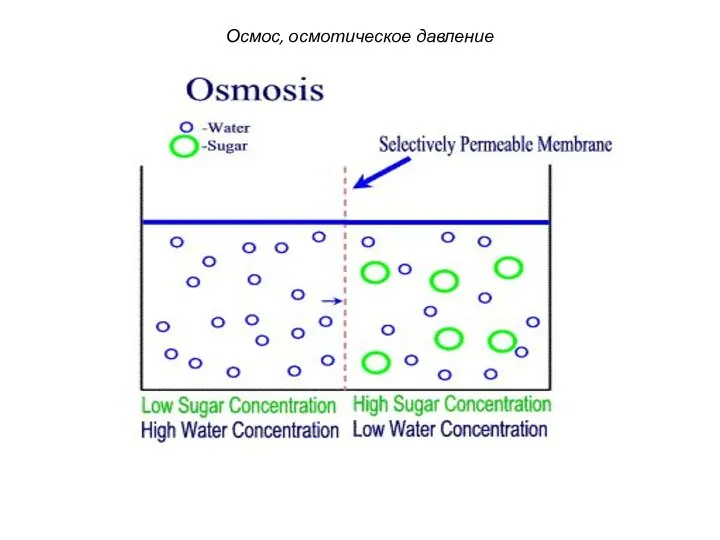
- 20. Осмосом называют преимущественно одностороннюю диффузию молекул растворителя (например, воды) через полупроницаемую мембрану из раствора с меньшей
- 21. Диффузия растворителя Разбавленный раствор Концентрированный раствор Растворитель Растворенное вещество Диффузия растворителя Осмос, осмотическое давление
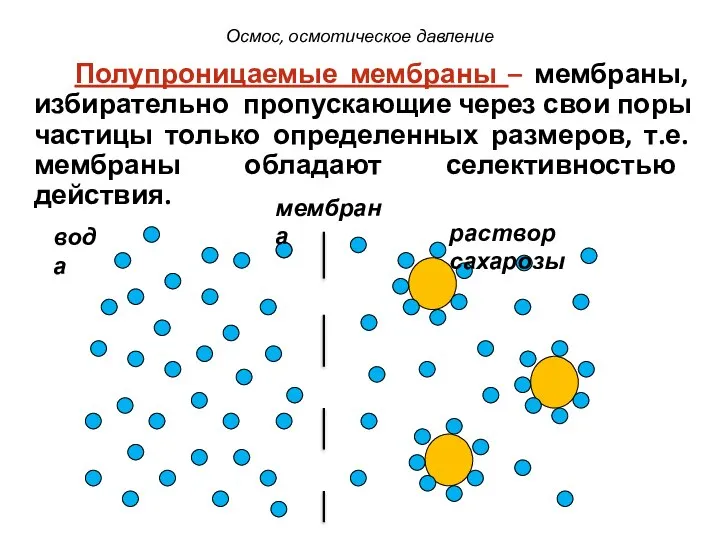
- 22. мембрана вода раствор сахарозы Полупроницаемые мембраны – мембраны, избирательно пропускающие через свои поры частицы только определенных
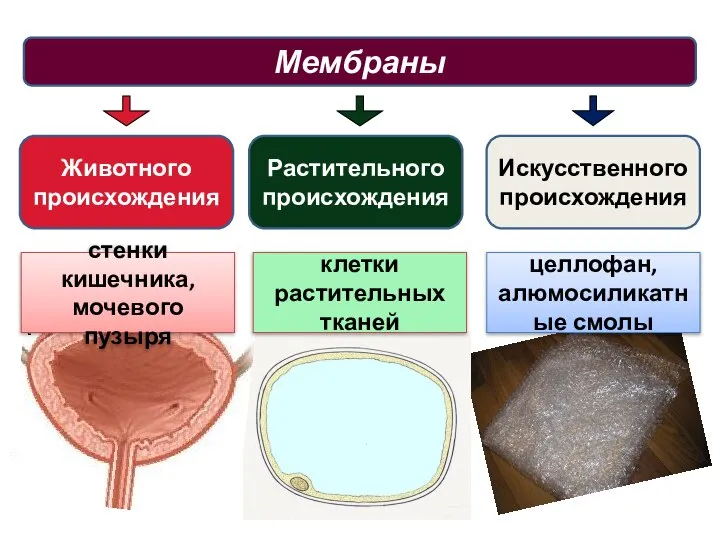
- 23. Мембраны Животного происхождения стенки кишечника, мочевого пузыря Растительного происхождения Искусственного происхождения клетки растительных тканей целлофан, алюмосиликатные
- 24. Мембраны животного происхождения свободно пропускают неорганические ионы и низкомолекулярные вещества, а задерживают высокомолекулярные структуры белков, пептидов,
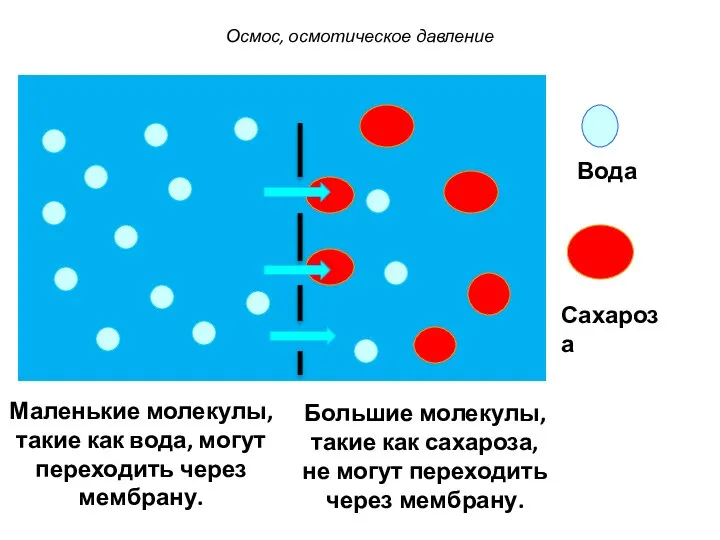
- 25. Вода Сахароза Маленькие молекулы, такие как вода, могут переходить через мембрану. Большие молекулы, такие как сахароза,
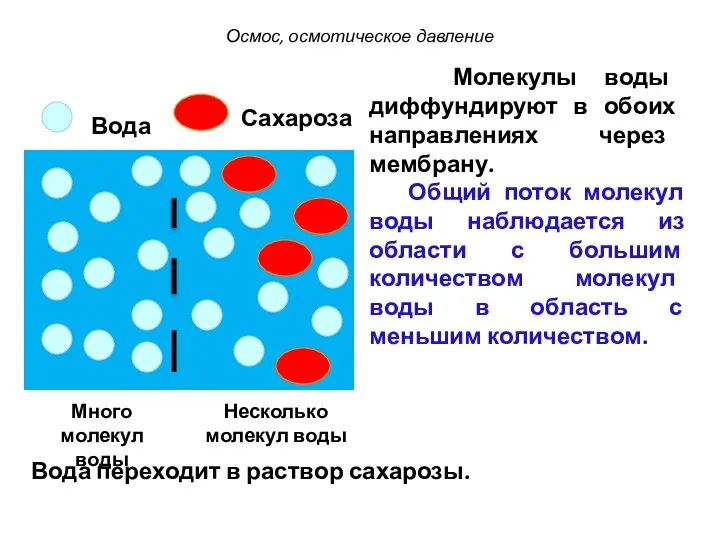
- 26. Молекулы воды диффундируют в обоих направлениях через мембрану. Общий поток молекул воды наблюдается из области с
- 27. С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию свойств, в данном случае
- 28. Осмос, осмотическое давление
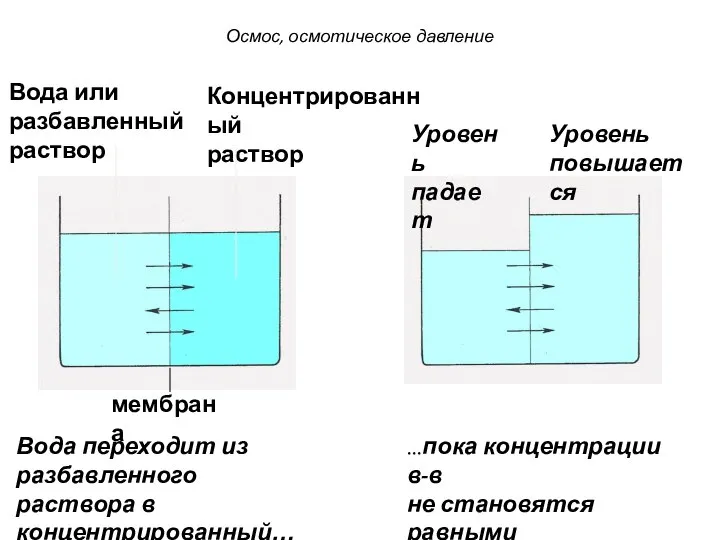
- 29. Вода или разбавленный раствор Концентрированный раствор мембрана Вода переходит из разбавленного раствора в концентрированный… Уровень повышается
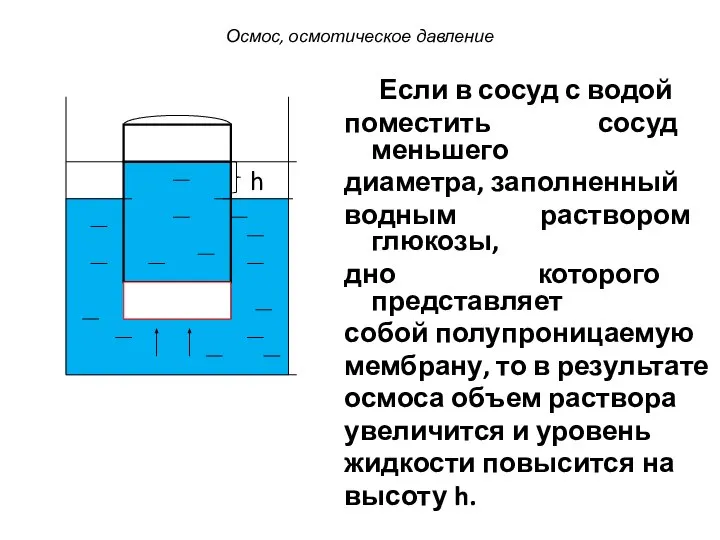
- 30. Если в сосуд с водой поместить сосуд меньшего диаметра, заполненный водным раствором глюкозы, дно которого представляет
- 31. При этом создается дополнительное гидростатическое давление столба жидкости высотой h на мембрану и возрастает вероятность обратного
- 32. Осмотическим давлением раствора называют величину, измеряемую минимальным дополнительным гидростатическим давлением, которое нужно приложить к мембране со
- 33. Осмотическое давление рассчитывается по уравнению Вант-Гоффа (1887 г.) Ученый рассмотрел поведение частиц вещества в растворе аналогично
- 34. Уравнение осмотического давления (π) Вант-Гоффа: Если учесть, что , то получим: или , Осмос, осмотическое давление
- 35. , где π – осмотическое давление, Па; R - универсальная газовая постоянная, R = 8,314 Дж∙моль-1∙К-1;
- 36. Для расчета осмотического давления растворов электролитов вводят изотонический коэффициент Вант-Гоффа i: Осмос, осмотическое давление
- 37. Изотонический коэффициент Вант-Гоффа рассчитывается по формуле: , где Ni – число частиц в растворе, Nо –
- 38. Величина изотонического коэффициента зависит от степени диссоциации α (в долях от единицы) и числа дочерних частиц
- 39. Осмотическое давление в растворе электролита зависит от силы электролита, т.е. от степени его диссоциации, состава молекулы,
- 40. В растворах высокомолекулярных веществ осмотическое давление рассчитывают по уравнению Галлера: , где СВМВ – весовая концентрация
- 41. Биологическая роль осмоса
- 42. Осмос играет огромную роль в жизнедеятельности организма. Благодаря осмосу, регулируется поступление воды в клетку и межклеточные
- 43. Осмос является одним из механизмов мембранного потенциала клетки: , где ϕмембрана – мембранный потенциал клетки, мВ;
- 44. Основной причиной возникновения потенциала клетки является неравномерное распределение ионов калия и натрия между содержимым клетки и
- 45. Осмотический градиент, определяющий собой силу, с которой вода всасывается в клетку, численно равен разности между осмотическим
- 46. Растворы Изотонические Растворы, имеющие одинаковое осмотическое давление Гипертонические Гипотонические Растворы с большим осмотическим давлением по отношению
- 47. Действие слабительных средств - горькой соли MgS04 • 7Н20 и глауберовой соли Na2S04 • 10Н2О также
- 48. Осмос в клетках животного происхождения 1. Если живую клетку поместить в изотонический раствор, то клетка сохраняет
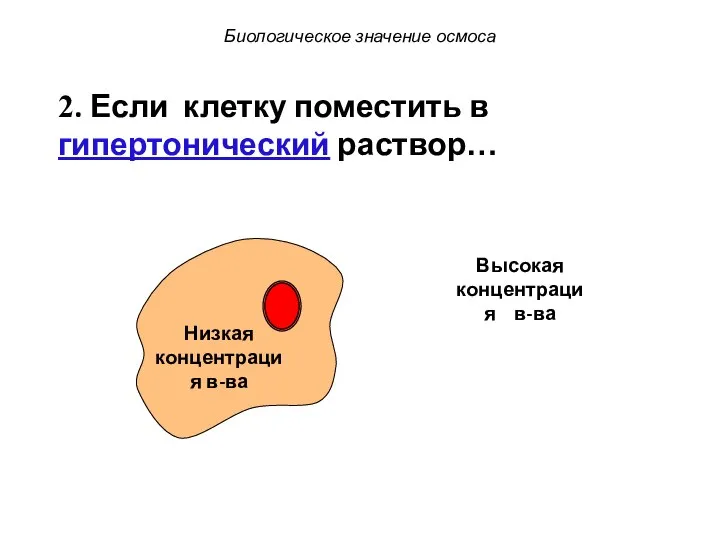
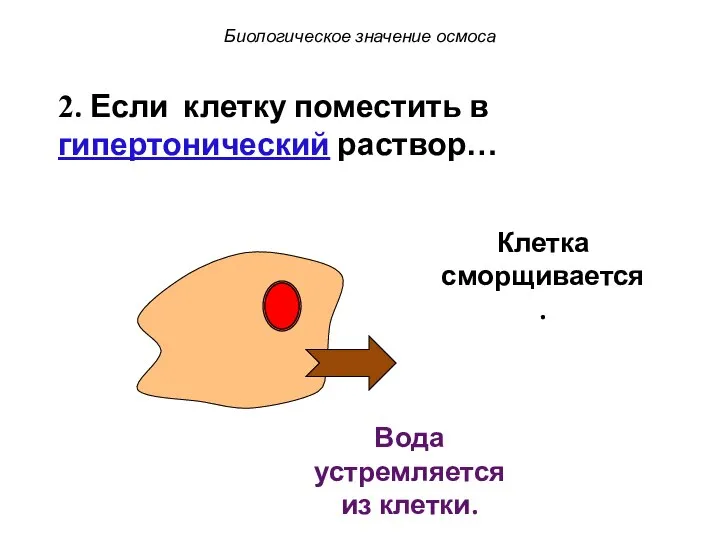
- 49. Биологическое значение осмоса 2. Если клетку поместить в гипертонический раствор…
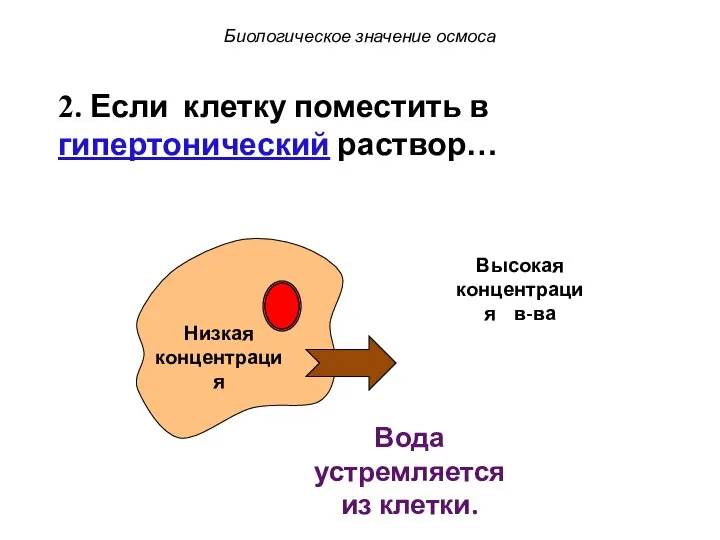
- 50. Низкая концентрация в-ва Высокая концентрация в-ва Биологическое значение осмоса 2. Если клетку поместить в гипертонический раствор…
- 51. Низкая концентрация Вода устремляется из клетки. Биологическое значение осмоса Высокая концентрация в-ва 2. Если клетку поместить
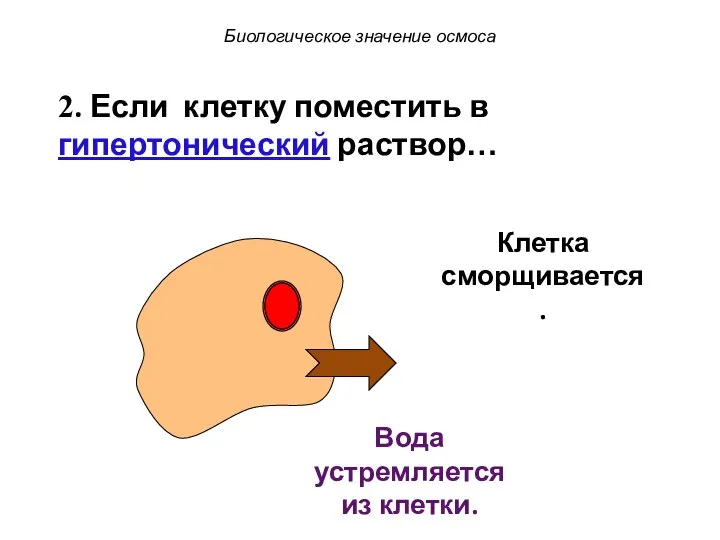
- 52. Клетка сморщивается. Биологическое значение осмоса Вода устремляется из клетки. 2. Если клетку поместить в гипертонический раствор…
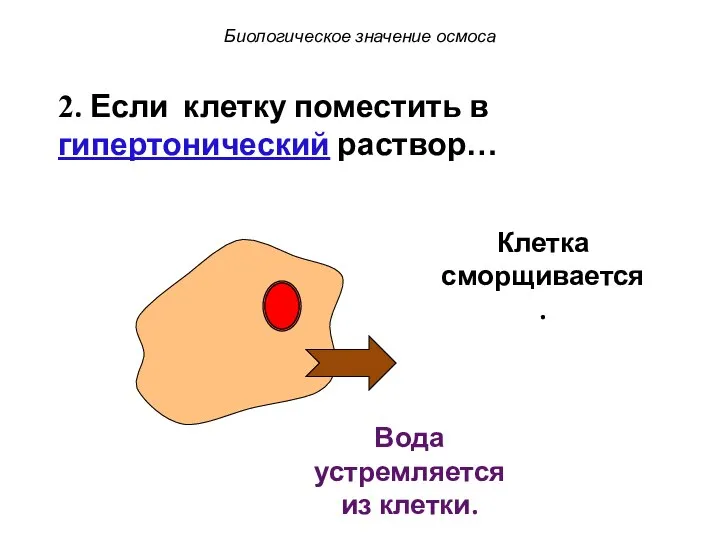
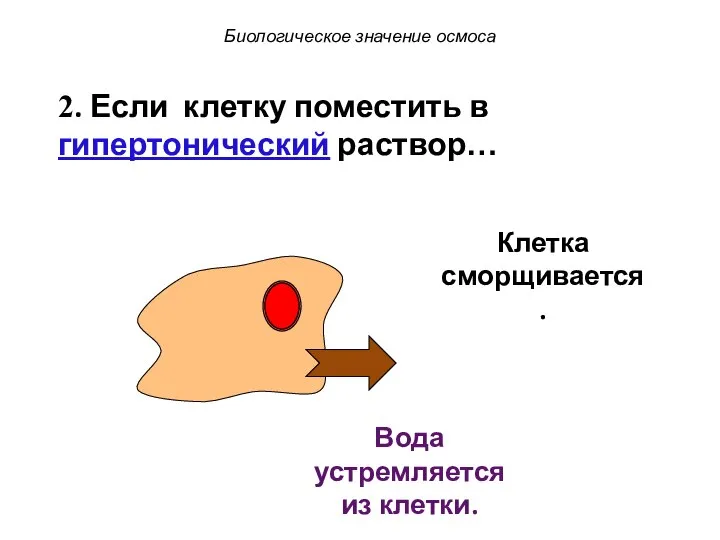
- 53. Клетка сморщивается. Биологическое значение осмоса Вода устремляется из клетки. 2. Если клетку поместить в гипертонический раствор…
- 54. Клетка сморщивается. Биологическое значение осмоса Вода устремляется из клетки. 2. Если клетку поместить в гипертонический раствор…
- 55. Клетка сморщивается. Биологическое значение осмоса Вода устремляется из клетки. 2. Если клетку поместить в гипертонический раствор…
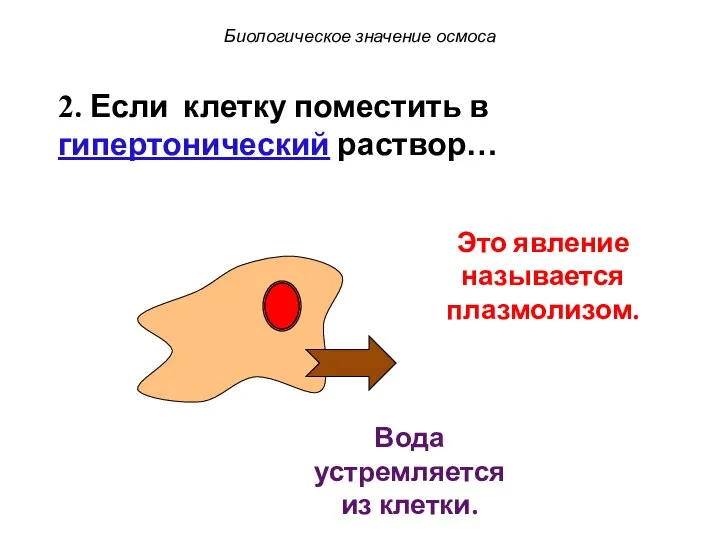
- 56. Это явление называется плазмолизом. Биологическое значение осмоса Вода устремляется из клетки. 2. Если клетку поместить в
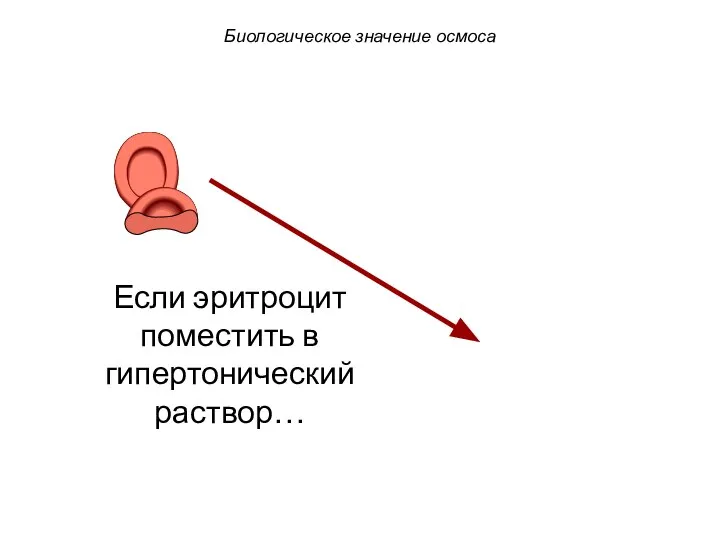
- 57. Если эритроцит поместить в гипертонический раствор… Биологическое значение осмоса
- 58. Если эритроцит поместить в гипертонический раствор… Вода устремляется из клетки. Клетка сморщивается (плазмолиз). Биологическое значение осмоса
- 59. В некоторых случаях плазмолиз является обратимым процессом, т.е. возможен деплазмолиз. Гипертонические растворы соли (рассол) и сахара
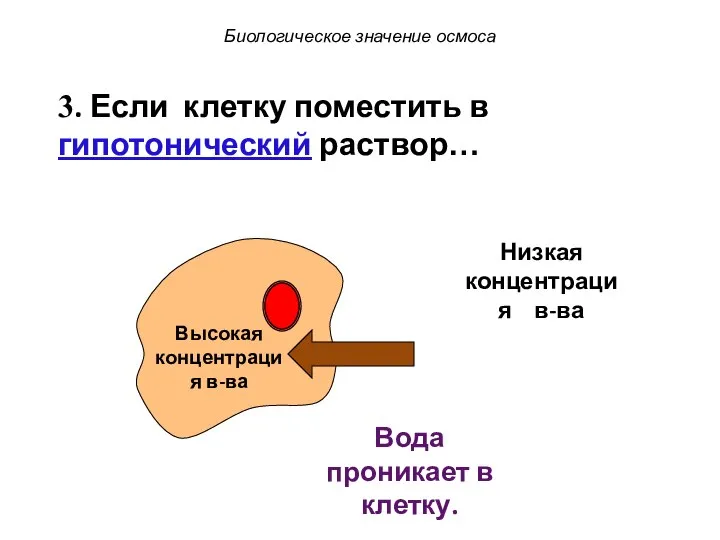
- 60. 3. Если клетку поместить в гипотонический раствор… Биологическое значение осмоса
- 61. Низкая концентрация в-ва Высокая концентрация в-ва 3. Если клетку поместить в гипотонический раствор… Вода проникает в
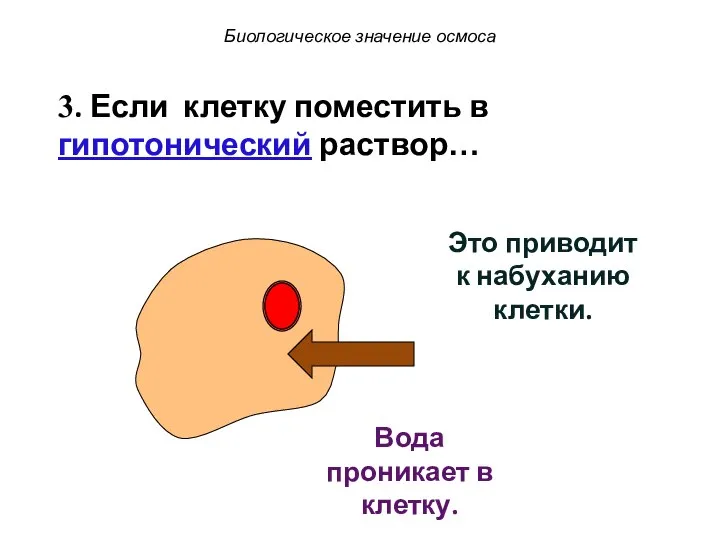
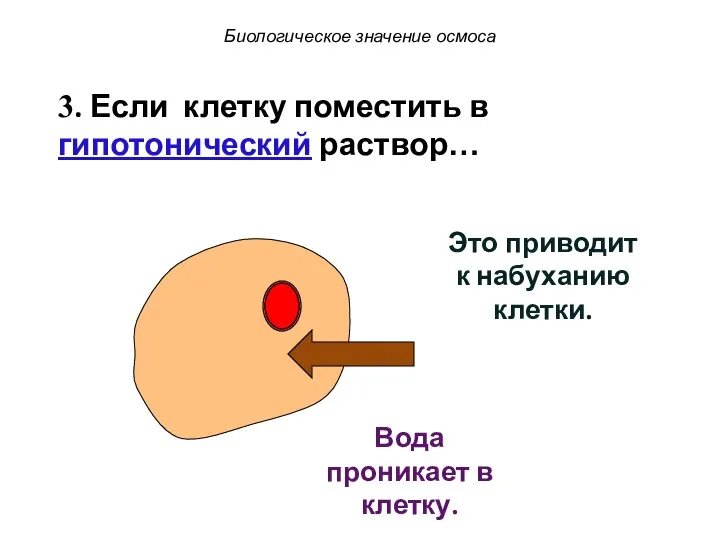
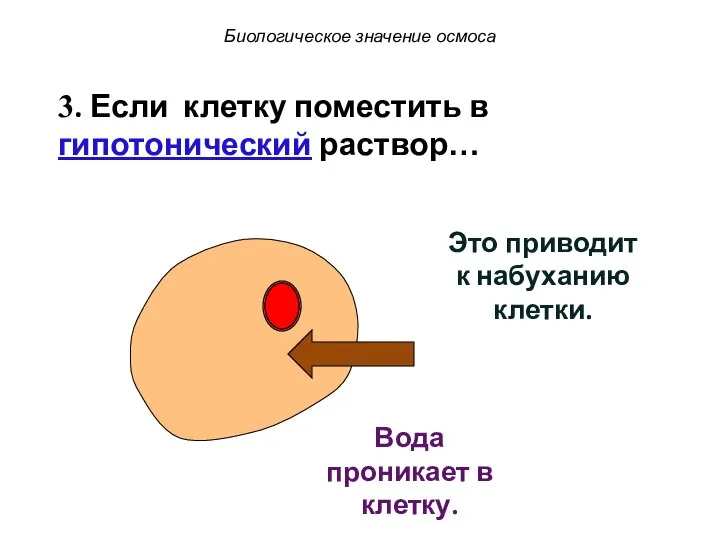
- 62. Это приводит к набуханию клетки. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку.
- 63. Это приводит к набуханию клетки. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку.
- 64. Это приводит к набуханию клетки. Вода проникает в клетку. 3. Если клетку поместить в гипотонический раствор…
- 65. Это явление называют лизисом. В конечном итоге клетка лопается. Вода проникает в клетку. 3. Если клетку
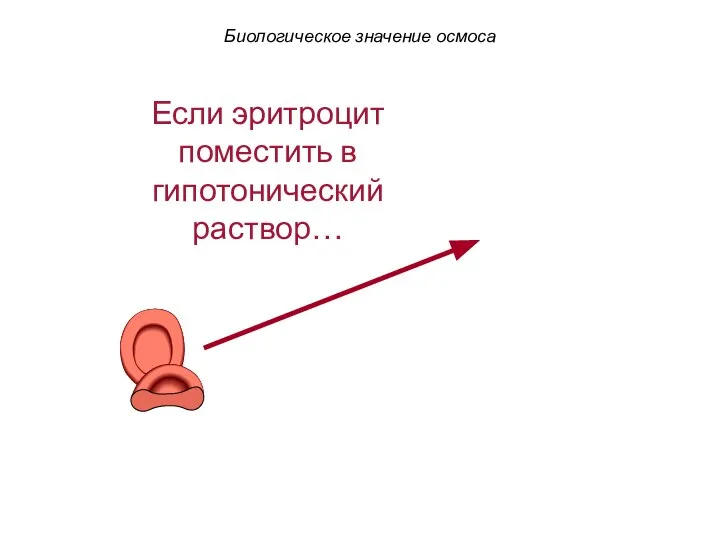
- 66. Если эритроцит поместить в гипотонический раствор… Биологическое значение осмоса
- 67. Если эритроцит поместить в гипотонический раствор… Вода устремляется в клетку. Оболочка клетки разрывается (гемолиз). Биологическое значение
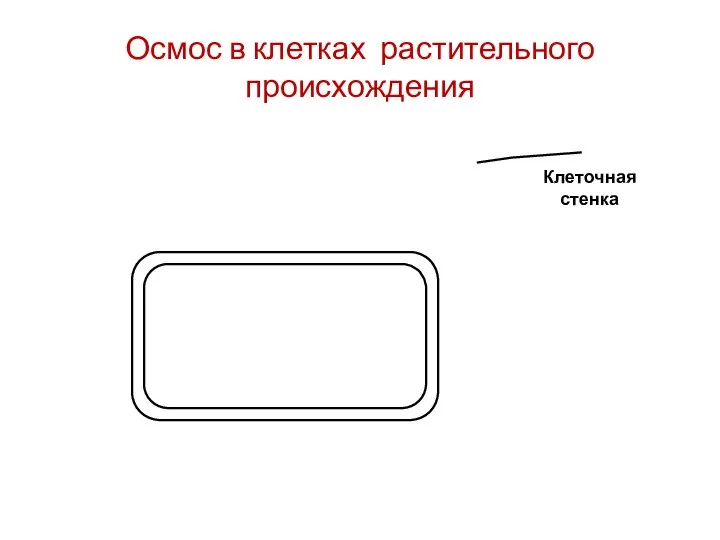
- 68. Клеточная стенка Осмос в клетках растительного происхождения
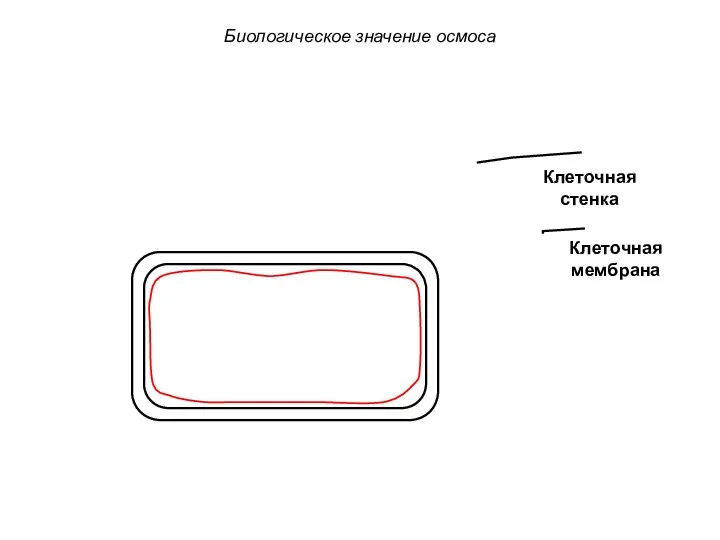
- 69. Клеточная стенка Клеточная мембрана Биологическое значение осмоса
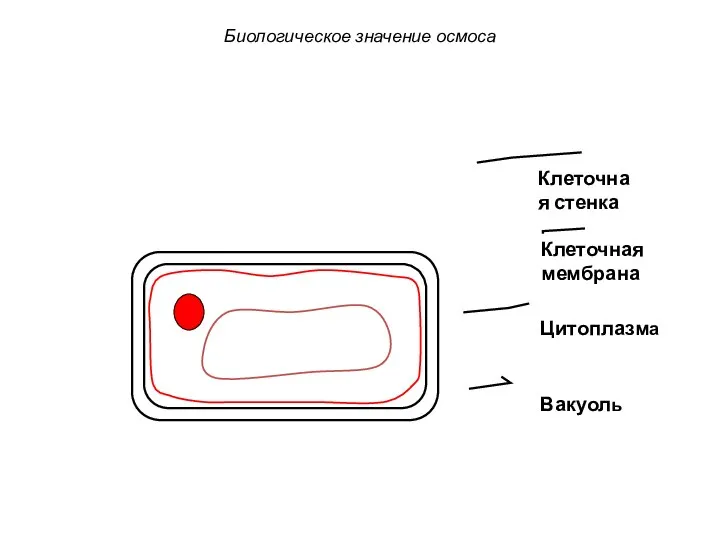
- 70. Клеточная стенка Клеточная мембрана Цитоплазма Вакуоль Биологическое значение осмоса
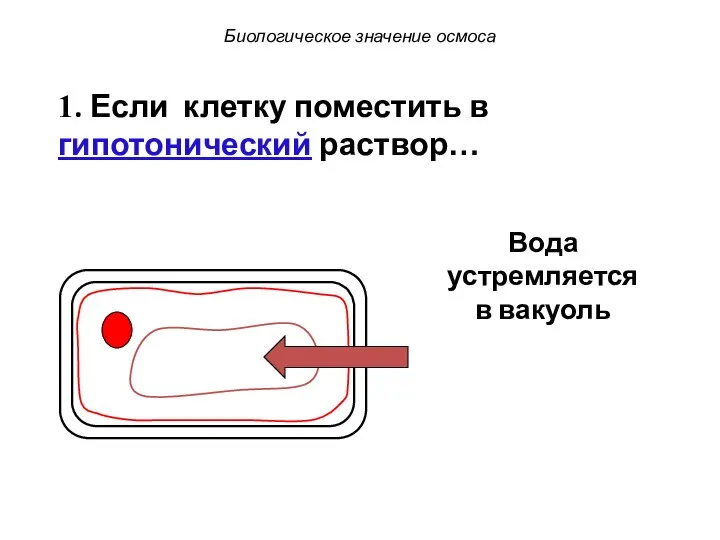
- 71. Биологическое значение осмоса 1. Если клетку поместить в гипотонический раствор… Вода устремляется в вакуоль
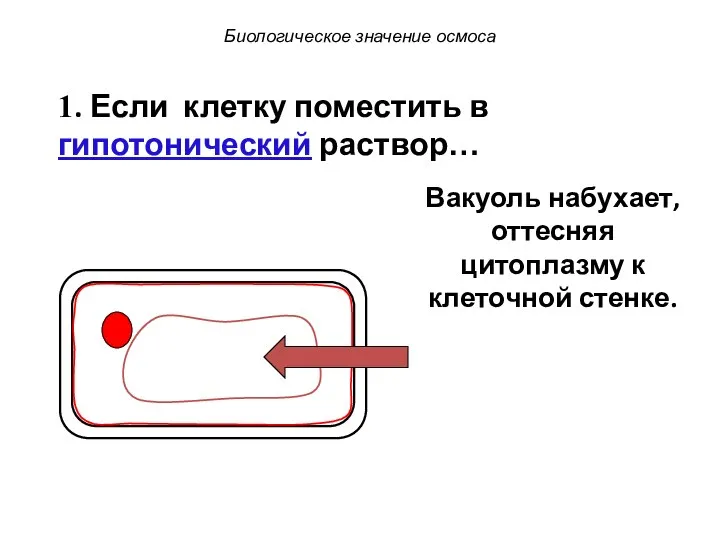
- 72. Биологическое значение осмоса 1. Если клетку поместить в гипотонический раствор… Вакуоль набухает, оттесняя цитоплазму к клеточной
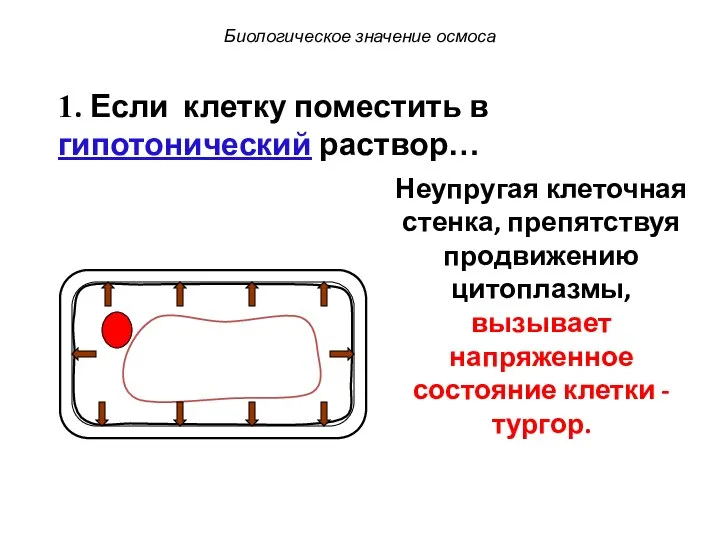
- 73. Биологическое значение осмоса 1. Если клетку поместить в гипотонический раствор… Неупругая клеточная стенка, препятствуя продвижению цитоплазмы,
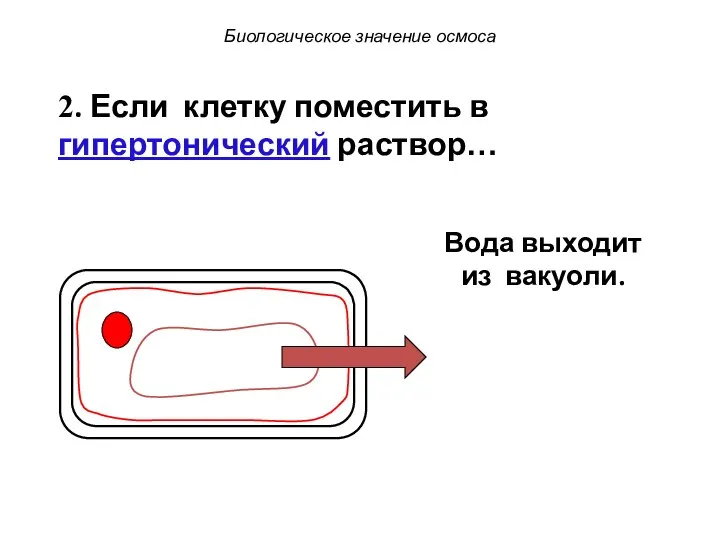
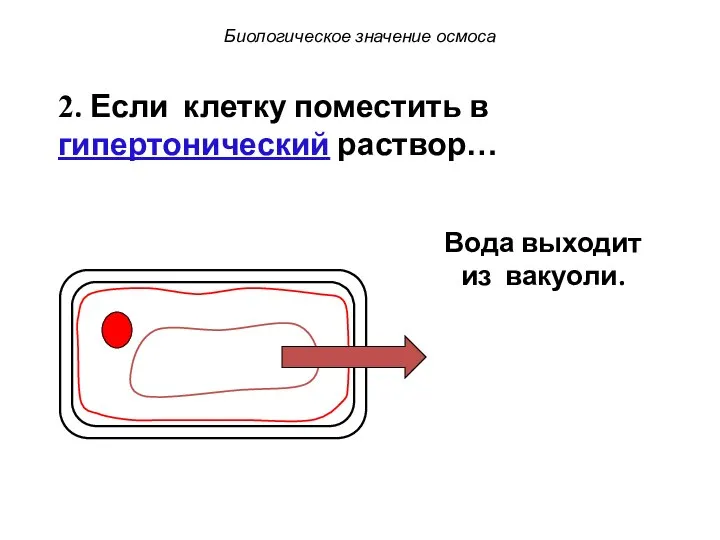
- 74. Биологическое значение осмоса 2. Если клетку поместить в гипертонический раствор… Вода выходит из вакуоли.
- 75. Биологическое значение осмоса 2. Если клетку поместить в гипертонический раствор… Вода выходит из вакуоли.
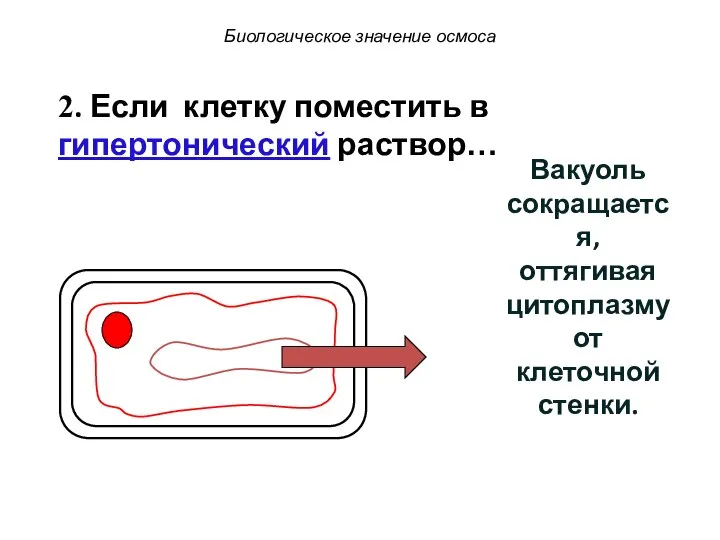
- 76. Биологическое значение осмоса 2. Если клетку поместить в гипертонический раствор… Вакуоль сокращается, оттягивая цитоплазму от клеточной
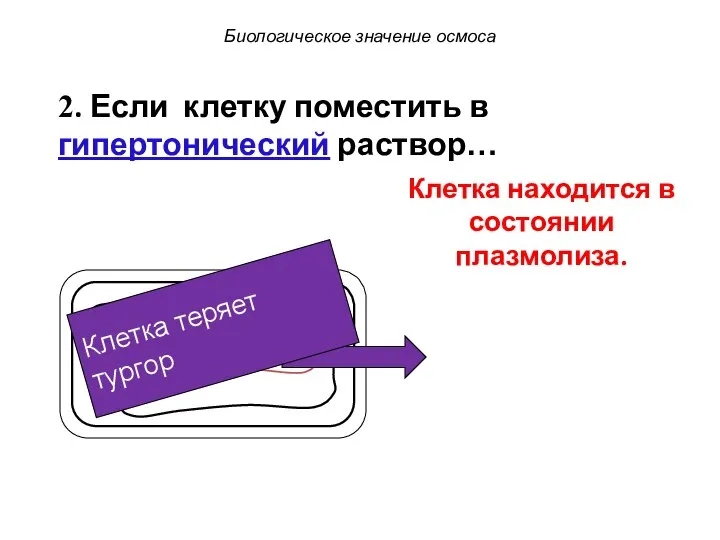
- 77. Клетка теряет тургор 2. Если клетку поместить в гипертонический раствор… Клетка находится в состоянии плазмолиза. Биологическое
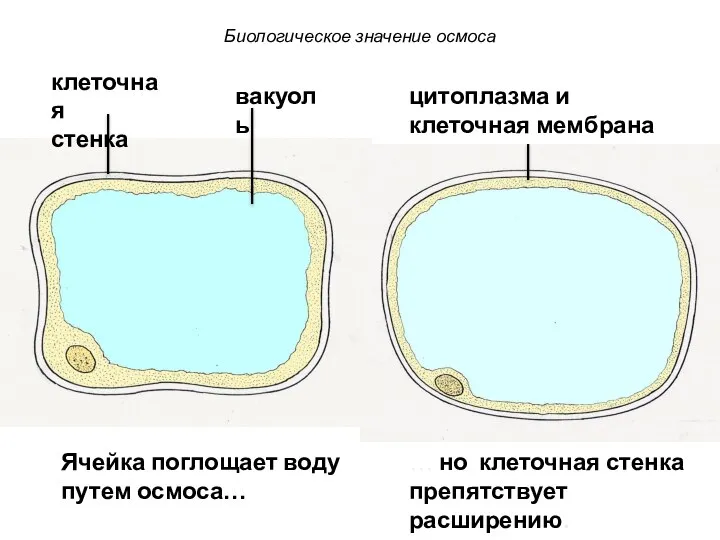
- 78. клеточная стенка цитоплазма и клеточная мембрана вакуоль Ячейка поглощает воду путем осмоса… … но клеточная стенка
- 79. Если концентрация клеточного сока больше в одной клетке, чем в соседней, вода будет проходить путем осмоса
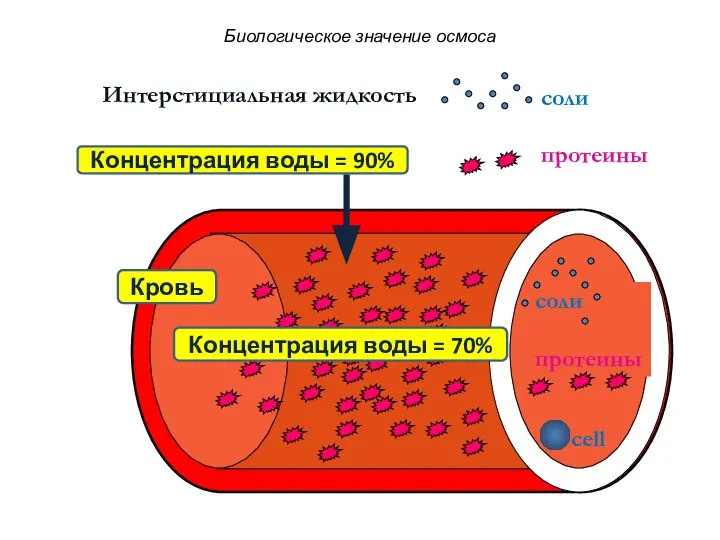
- 80. Часть осмотического давления крови, обусловленная присутствием в ней высокомолекулярных веществ (главным образом, белков), называют онкотическим давлением.
- 81. соли протеины Интерстициальная жидкость соли протеины cell Концентрация воды = 90% Концентрация воды = 70% Кровь
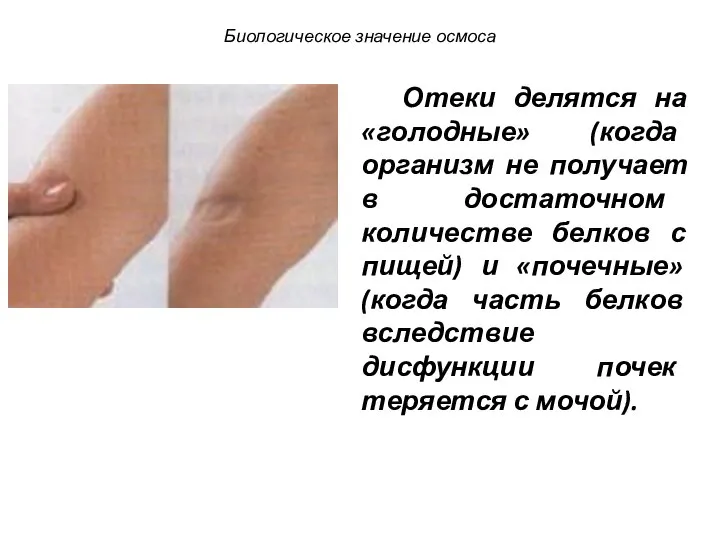
- 82. Отеки делятся на «голодные» (когда организм не получает в достаточном количестве белков с пищей) и «почечные»
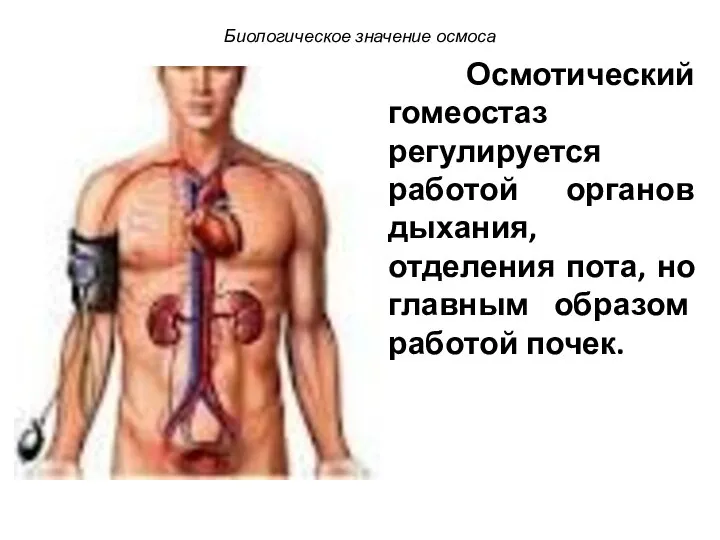
- 83. Осмотический гомеостаз регулируется работой органов дыхания, отделения пота, но главным образом работой почек. Биологическое значение осмоса
- 84. Вопросы для самоконтроля Сформулируйте закон Рауля для неэлектролитов и его следствия. По каким формулам можно рассчитать
- 86. Скачать презентацию












































 Материаловедение. Теория термической обработки стали. (Тема 8)
Материаловедение. Теория термической обработки стали. (Тема 8) Кобаламины(витамин В12) антианемический
Кобаламины(витамин В12) антианемический Лекция №4. Строение металлических сплавов
Лекция №4. Строение металлических сплавов Металлы в продуктах питания
Металлы в продуктах питания Технология производства химических волокон. Свойства химических волокон и тканей из них (7 класс)
Технология производства химических волокон. Свойства химических волокон и тканей из них (7 класс) Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Растворы. Определения и понятия
Растворы. Определения и понятия Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Петрография
Петрография Семинар «Фотосинтез»
Семинар «Фотосинтез» An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Склероглюкан
Склероглюкан Элементы группы галогенов
Элементы группы галогенов Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Типы химических связей
Типы химических связей Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Применение нитратов
Применение нитратов  Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Химическая связь. Лекция 2
Химическая связь. Лекция 2 Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Плотнейшие упаковки одинаковых сфер
Плотнейшие упаковки одинаковых сфер Производство азотной кислоты
Производство азотной кислоты Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое
Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое Производство ацетальдегида
Производство ацетальдегида Классификация титановых сплавов
Классификация титановых сплавов Физико-химические основы разделения горючих ископаемых и продуктов их переработки. Хроматография
Физико-химические основы разделения горючих ископаемых и продуктов их переработки. Хроматография