Содержание
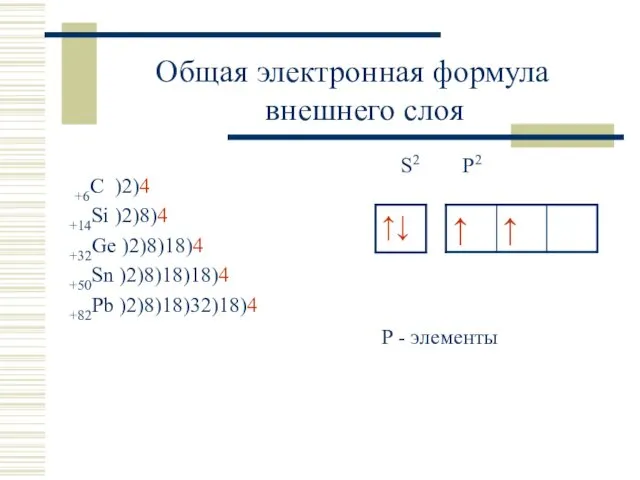
- 2. +6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4 +50Sn )2)8)18)18)4 +82Pb )2)8)18)32)18)4 S2 P2 Р - элементы Общая
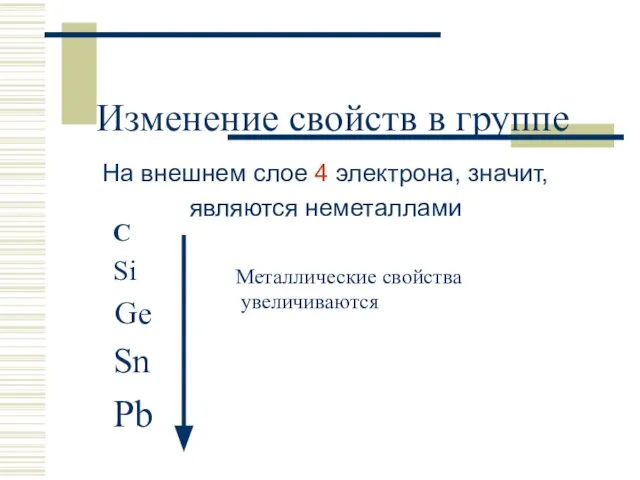
- 3. Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются
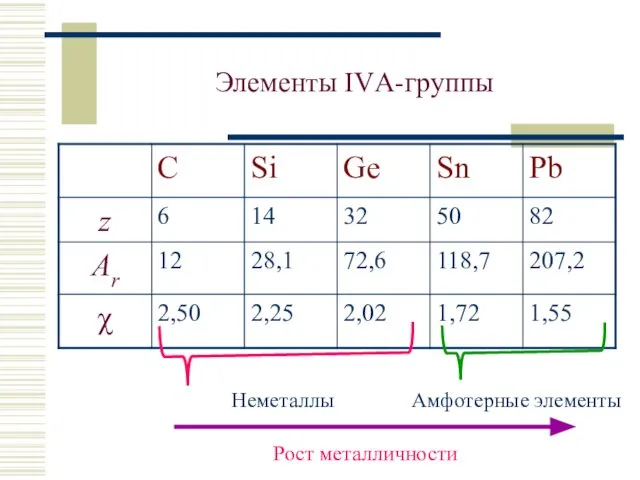
- 4. Элементы IVА-группы Неметаллы Амфотерные элементы
- 5. Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Si, Ge, Sn,
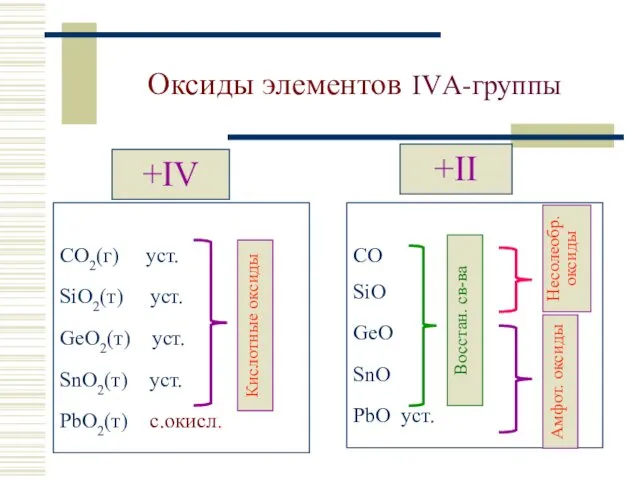
- 6. Оксиды элементов IVА-группы +IV CO2(г) уст. SiO2(т) уст. GeO2(т) уст. SnO2(т) уст. PbO2(т) с.окисл. +II CO
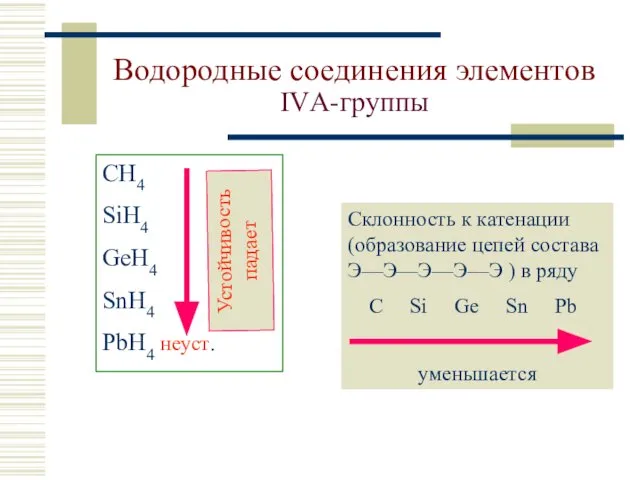
- 7. Водородные соединения элементов IVА-группы СH4 SiH4 GeH4 SnH4 PbH4 неуст. Склонность к катенации (образование цепей состава
- 8. Простые вещества Аллотропия Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Олово «белое» и «серое». Структура
- 9. Химические свойства При комн. темп. С, Si, Ge + H2O ≠ Sn, Pb + H2O ≠
- 10. Химические свойства С(т) + KOH ≠ Si + 4NaOH = Na4SiO4 + 2H2↑
- 11. Распространение в природе и важнейшие минералы 2. Si 25,80% (27,72% в литосфере) 13. C 0,087% (0,032%
- 12. Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты
- 13. Германий, олово и свинец
- 14. Шкала степеней окисления углерода CO2, CO32−, H2CO3, Na2CO3, CS2, CF4, CCl2O, C(NH2)2O CO, HCN, C2F4 C
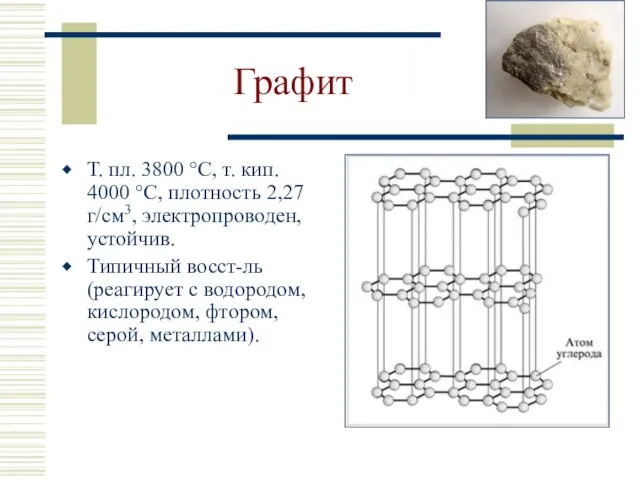
- 15. Графит Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль
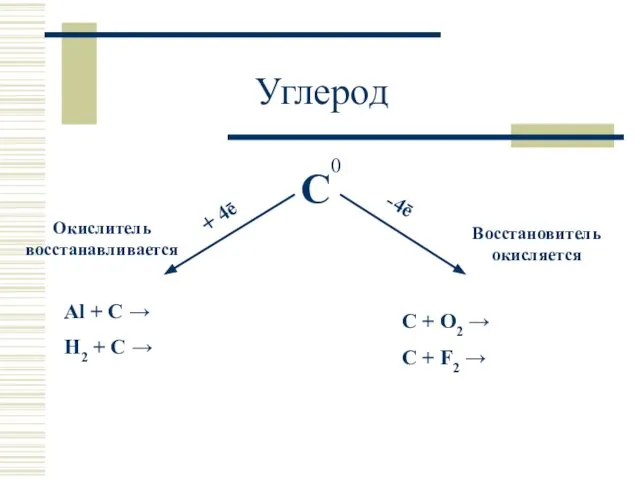
- 16. 0 Углерод
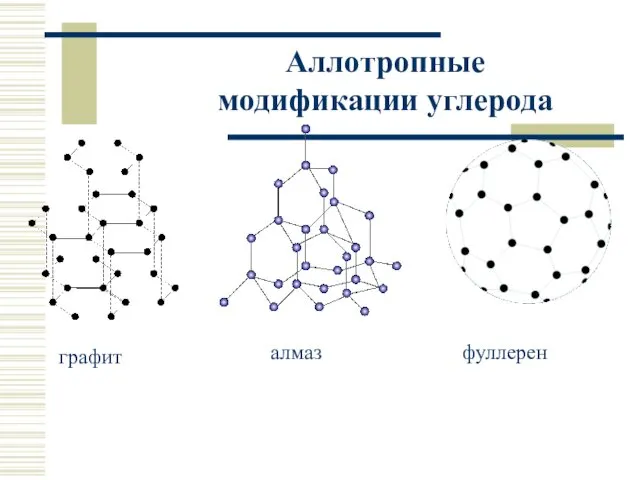
- 17. Аллотропные модификации углерода графит алмаз фуллерен
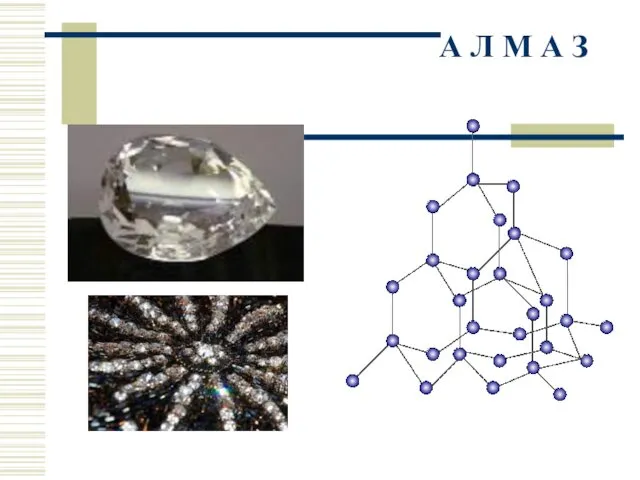
- 18. А Л М А З
- 19. Звезда ордена Св. Андрея Первозванного Алмаз «Шах» Скипетр императорский
- 20. Большая императорская корона Малая императорская корона
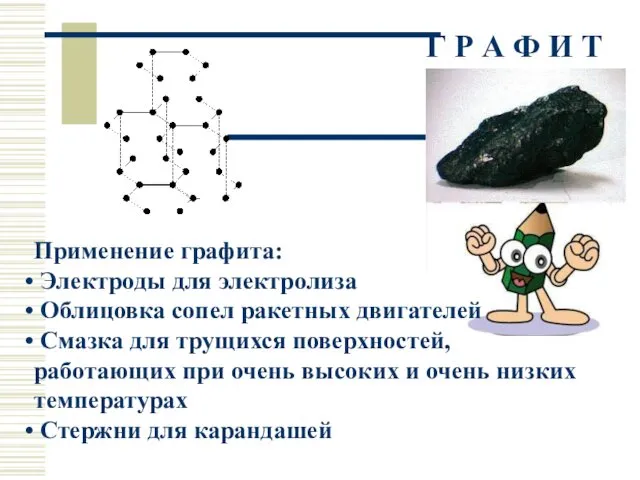
- 21. Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка
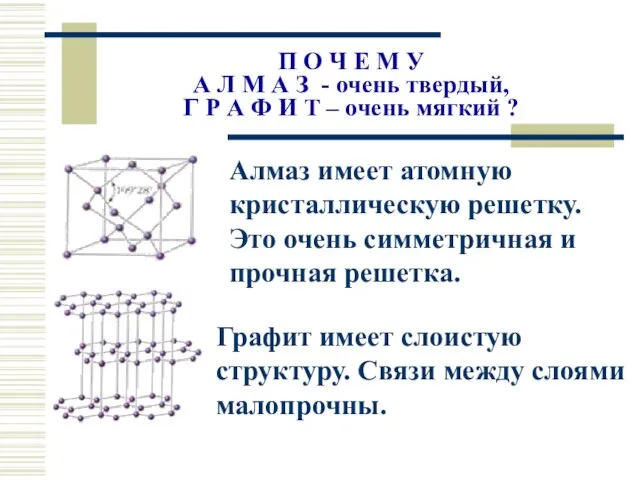
- 22. П О Ч Е М У А Л М А З - очень твердый, Г Р
- 23. Угольные фильтры В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества
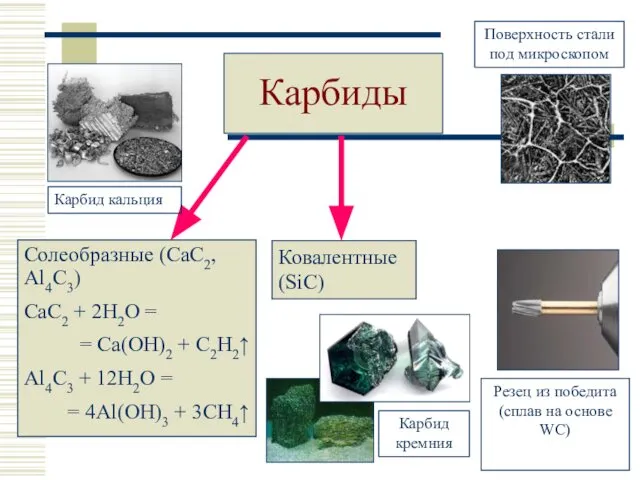
- 24. Карбиды
- 25. Водородные соединения. Метан CH4 СН4 – газ без цвета и запаха, горюч, главная сост. часть природного
- 26. Монооксид углерода CO – несолеобразующий оксид Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, ядовит
- 27. Диоксид углерода CO2 (кислотный оксид) Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при
- 28. Моногидрат CO2 . H2O и угольная кислота H2CO3 В водном растворе: CO2 (г) + H2O ⮀
- 29. Псевдогалогениды Циановодород HCN В водн. р-ре – слабая «синильная кислота»: HCN + H2O ⮀ CN– +
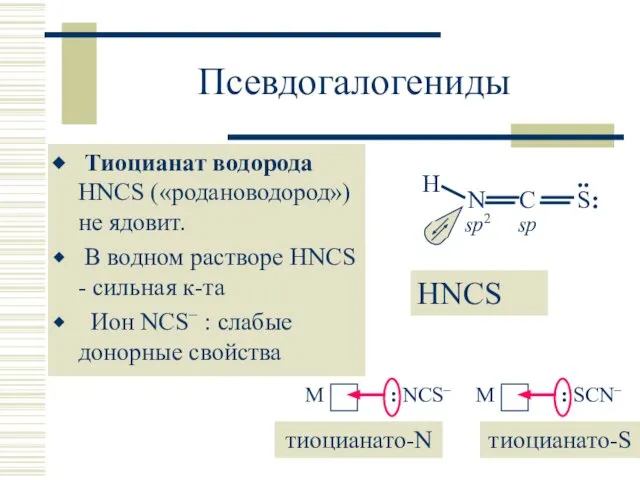
- 30. Псевдогалогениды Тиоцианат водорода HNCS («родановодород») не ядовит. В водном растворе HNCS - сильная к-та Ион NCS−
- 32. аллотропия КРЕМНИЯ Кристаллический кремний Аморфный кремний
- 33. Нахождение в природе SiO2 кремнезём (песок) Al2O3∙ 2SiO2∙2H2O каолинит (глина) По распространенности занимает второе место после
- 34. ПРИМЕНЕНИЕ КРЕМНИЯ Кремнистые стали Силиконовый каучук Фотоэлементы Силиконовый герметик
- 36. Получение кремния SiO2 + 2C = Si + 2CO SiO2 + 2Mg = 2MgO + Si
- 37. Водородные соединения SinH2n+2 (силаны) Моносилан SiH4: SiH4 + 2O2 = SiO2 + 2H2O Получение силанов: SiO2
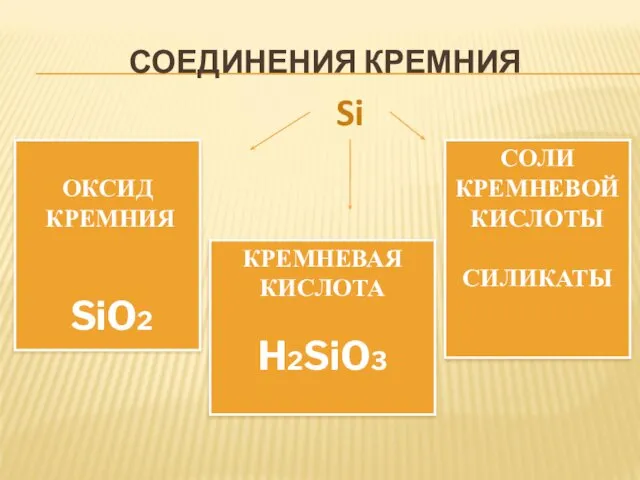
- 38. СОЕДИНЕНИЯ КРЕМНИЯ ОКСИД КРЕМНИЯ SiO2 КРЕМНЕВАЯ КИСЛОТА H2SiO3 СОЛИ КРЕМНЕВОЙ КИСЛОТЫ СИЛИКАТЫ Si
- 39. ОКСИД КРЕМНИЯ - SiO2 песок горный хрусталь (кварц) аметист
- 40. Взаимодействие кремния с кислородом Si + O2 = SiO2
- 41. Кислородные соединения -SiO2 оксид кремния SiO2 + 2NaOH = Na2SiO3 + H2O (силикат натрия)
- 42. Травление стекла SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода) Травление — в технике,
- 43. КРЕМНЕВАЯ КИСЛОТА H2SIO3 Na2SiO3 + 2HCl = 2NaCl + H2SiO3 ↓ кремневая кислота Получение: Кремниевая кислота
- 44. Получение кремниевой кислоты https://www.youtube.com/watch?v=hB6GOzNFEaA
- 46. Скачать презентацию
![Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/483140/slide-4.jpg)
























![Травление стекла SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/483140/slide-41.jpg)


 Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Обмен белков и аминокислот. Азотистый баланс. (Лекция 14)
Обмен белков и аминокислот. Азотистый баланс. (Лекция 14) Аттестационная работа. Рабочая программа по курсу внеурочной деятельности для обучающихся 7 класса «Химия в профессиях»
Аттестационная работа. Рабочая программа по курсу внеурочной деятельности для обучающихся 7 класса «Химия в профессиях» Нанопористые материалы
Нанопористые материалы Выполнили: обучающиеся 10 класса Плотникова А. и Вартанян О. МОУ «Новопоселеновская СОШ»
Выполнили: обучающиеся 10 класса Плотникова А. и Вартанян О. МОУ «Новопоселеновская СОШ» Химические реакторы
Химические реакторы Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Познавательная игра. Химия!
Познавательная игра. Химия! Cкорость химической реакции
Cкорость химической реакции Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Аттестационная работа. Мыловарение. Создание мыла своими руками
Аттестационная работа. Мыловарение. Создание мыла своими руками Получение и применение радиоактивных изотопов. (9 класс)
Получение и применение радиоактивных изотопов. (9 класс) Физические и химические явления. Химические реакции
Физические и химические явления. Химические реакции Физическая химия тугоплавких неметаллических и силикатных материалов. Дисперсные системы. (Лекции 1-3)
Физическая химия тугоплавких неметаллических и силикатных материалов. Дисперсные системы. (Лекции 1-3) Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Презентация по Химии "Фотосинтез" - скачать смотреть
Презентация по Химии "Фотосинтез" - скачать смотреть  Химия элементов. Лекция 7 Общая характеристика элементов IIБ-группы. Цинк и кадмий. Ртуть
Химия элементов. Лекция 7 Общая характеристика элементов IIБ-группы. Цинк и кадмий. Ртуть  Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5)
Обмен веществ. Регуляция водно-солевого обмена. (Лекция 5) Моделирование химического состава азот-аргон-алюминиевой плазмы
Моделирование химического состава азот-аргон-алюминиевой плазмы Химические реакции
Химические реакции Аморфные тела
Аморфные тела Пегматитовые месторождения
Пегматитовые месторождения Технология кварцевого стекла
Технология кварцевого стекла Процессы нитрования
Процессы нитрования Эксперимент. Качественная реакция на крахмал
Эксперимент. Качественная реакция на крахмал Соли. Названия солей
Соли. Названия солей Белки
Белки Многоликая уксусная кислота
Многоликая уксусная кислота