Содержание
- 2. d-элементы: […] ns1÷2(n–2)f 14(n–1)d 0÷10np0 Многообразие степеней окисления (от 0 до +VIII), склонность к ОВР. Низшие
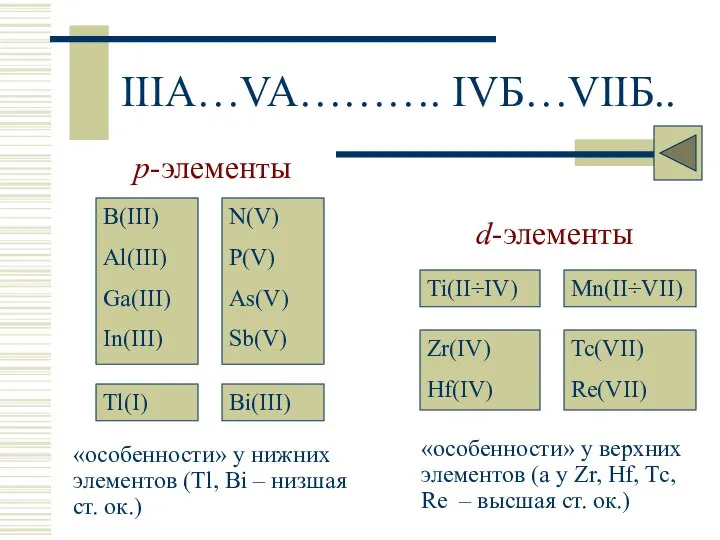
- 3. IIIA…VA………. IVБ…VIIБ.. «особенности» у нижних элементов (Tl, Bi – низшая ст. ок.) «особенности» у верхних элементов
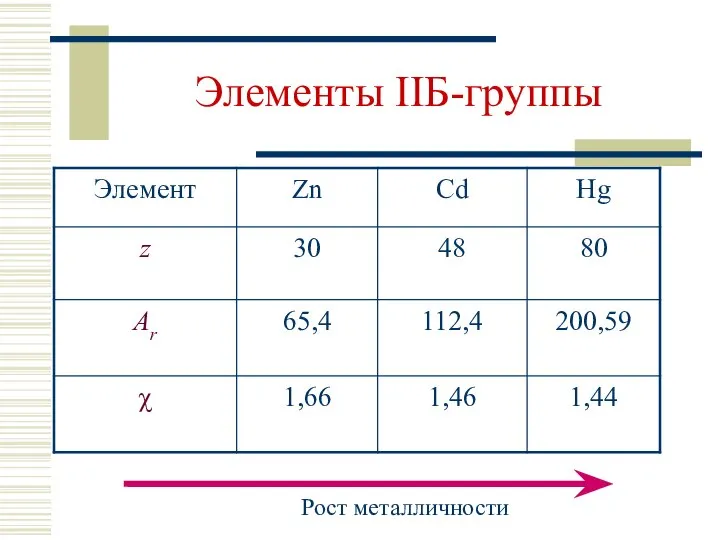
- 4. Элементы IIБ-группы
- 5. Элементы IIБ-группы Общая электронная формула: […] ns2 (n–1)d10 Степени окисления: +II, +I (Hg) КЧ –координационное число:
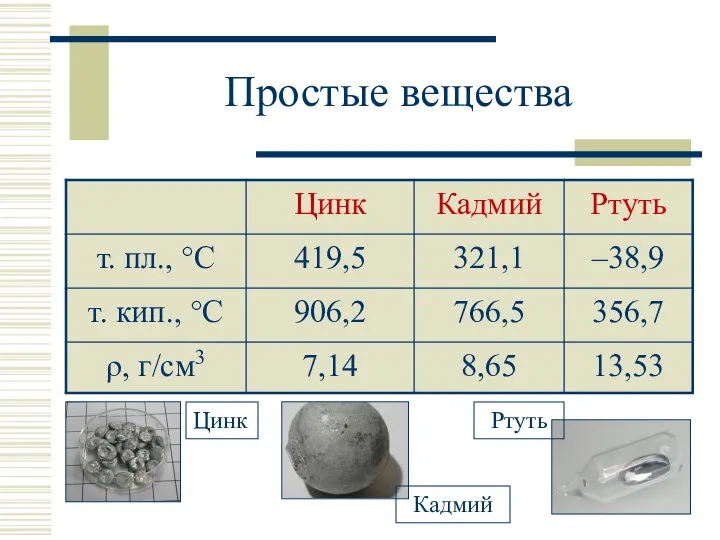
- 6. Простые вещества
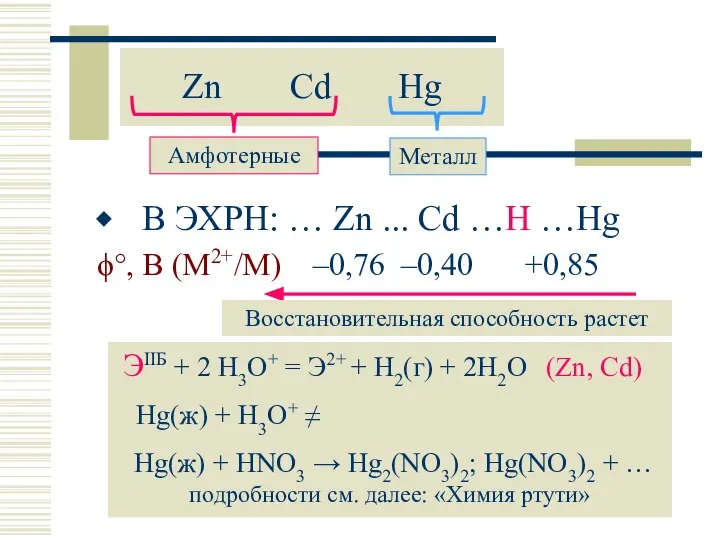
- 7. Zn Cd Hg В ЭХРН: … Zn ... Cd …H …Hg ϕ°, В (M2+/M) –0,76 –0,40
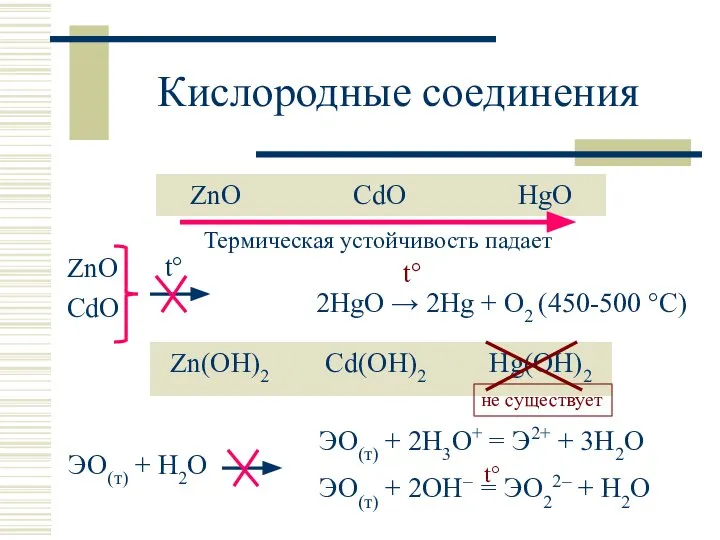
- 8. Кислородные соединения ZnO CdO HgO Zn(OH)2 Cd(OH)2 Hg(OH)2 ZnO CdO
- 9. Комплексные соединения ЭIIБ КЧ Тип гибр. Примеры Zn+II 4 sp3 [Zn(H2O)4]2+ [Zn(NH3)4]2+ Cd+II 6 sp3d2 [Cd(H2O)6]2+
- 10. Комплексные соединения [ZnI4]2– [CdI4]2– [HgI4]2– β(обр.) 4 · 10–3 1 · 106 5,6 · 1029 HgI2
- 11. Распространение в природе и важнейшие минералы В земной коре по массе 25. Zn 0,012 % 63.
- 12. Цинк и кадмий
- 13. Цинк и кадмий Zn + 2 H3O+ + 2H2O = [Zn+II(H2O)4]2+ + H2↑ ϕ° = –
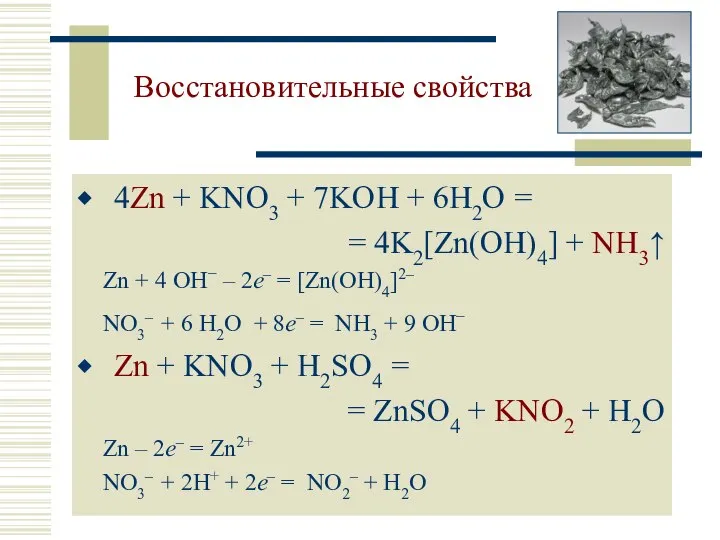
- 14. Восстановительные свойства 4Zn + KNO3 + 7KOH + 6H2O = = 4K2[Zn(OH)4] + NH3↑ Zn +
- 15. Комплексообразование Zn(OH)2 + 4 NH3.H2O = = [Zn(NH3)4](OH)2 + 4H2O (КЧ 4) Cd(OH)2 + 6 NH3.H2O
- 16. Особенности химии ртути Hg(ж) – летуча, ядовита CH3Hg+ – самый сильный яд Hg образует амальгамы (например
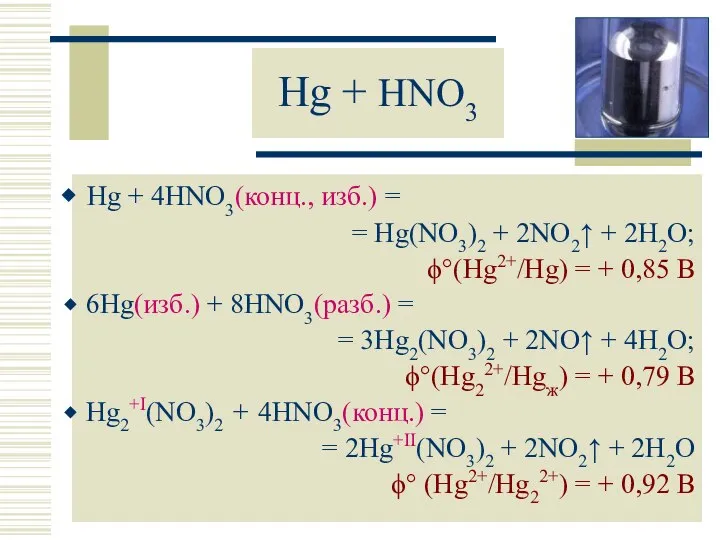
- 17. Hg + HNO3 Hg + 4HNO3(конц., изб.) = = Hg(NO3)2 + 2NO2↑ + 2H2O; ϕ°(Hg2+/Hg) =
- 18. Hg22+ ⮀ Hg0 + Hg2+ [(H2O)Hg–Hg(H2O)]2+ Hg2(NO3)2 = = Hg22+ + 2NO3− Каломель Hg2Cl2 Hg2Cl2(т) ⮀
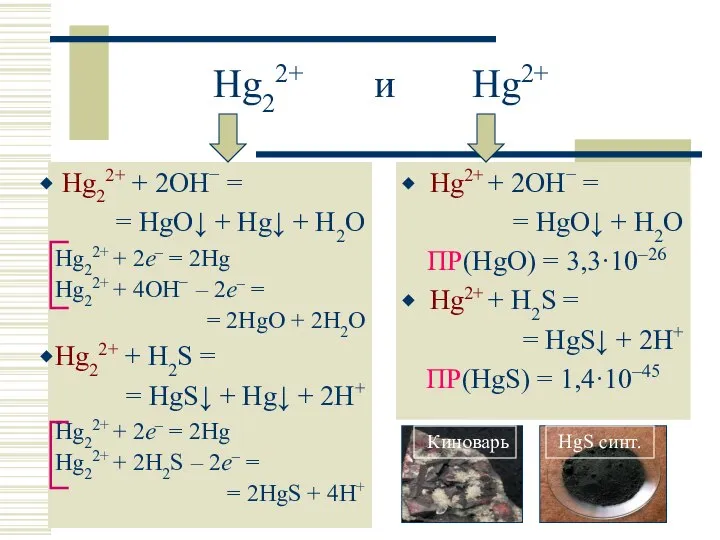
- 19. Hg22+ и Hg2+ Hg22+ + 2OH− = = HgO↓ + Hg↓ + H2O Hg22+ + 2e–
- 21. Скачать презентацию
![d-элементы: […] ns1÷2(n–2)f 14(n–1)d 0÷10np0 Многообразие степеней окисления (от 0 до](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-1.jpg)
![Элементы IIБ-группы Общая электронная формула: […] ns2 (n–1)d10 Степени окисления: +II,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-4.jpg)
![Комплексные соединения ЭIIБ КЧ Тип гибр. Примеры Zn+II 4 sp3 [Zn(H2O)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-8.jpg)
![Комплексные соединения [ZnI4]2– [CdI4]2– [HgI4]2– β(обр.) 4 · 10–3 1 ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-9.jpg)


![Цинк и кадмий Zn + 2 H3O+ + 2H2O = [Zn+II(H2O)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-12.jpg)
2 + 4H2O (КЧ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-14.jpg)

![Hg22+ ⮀ Hg0 + Hg2+ [(H2O)Hg–Hg(H2O)]2+ Hg2(NO3)2 = = Hg22+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1257134/slide-17.jpg)
 Презентация по Химии "Алкены." - скачать смотреть бесплатно_
Презентация по Химии "Алкены." - скачать смотреть бесплатно_ Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Энзимология. Структура и механизм действия ферментов. (Лекция 2)
Энзимология. Структура и механизм действия ферментов. (Лекция 2) Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) Фразеологизмы, которые пришли из химии
Фразеологизмы, которые пришли из химии ТВОРЦІ ХІМІЇ
ТВОРЦІ ХІМІЇ  Моносахариды, глюкоза
Моносахариды, глюкоза Биодеградируемые полимеры – продукты биотехнологии
Биодеградируемые полимеры – продукты биотехнологии Природные источники углеводородов
Природные источники углеводородов Виконала Гаєвська Зоряна Учениця 10 класу
Виконала Гаєвська Зоряна Учениця 10 класу  Теоретические аспекты
Теоретические аспекты Распределение химических веществ по классам
Распределение химических веществ по классам Металлы в нашей жизни
Металлы в нашей жизни Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Особенности химии фтора
Особенности химии фтора Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай
Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай  Экзогенная серия. Группа выветривания
Экзогенная серия. Группа выветривания Элементы симметрии кристаллических структур
Элементы симметрии кристаллических структур Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов
Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов Характеристика ядов, изолируемых минерализацией в клинической фармации
Характеристика ядов, изолируемых минерализацией в клинической фармации Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Нобелевские премии по химии
Нобелевские премии по химии Фации метаморфизма
Фации метаморфизма Химия и организм человека
Химия и организм человека Наука химия
Наука химия Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Комплексономертиялық титрлеу. Дәріс № 6
Комплексономертиялық титрлеу. Дәріс № 6