Содержание
- 2. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2,
- 3. Оксиды Оксиды – соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна
- 4. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
- 5. Классификация оксидов
- 6. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 7. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 8. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + HCl =
- 9. Кислотные оксиды Это оксиды, которым в качестве гидроксидов соответствуют кислоты. Например: SO3 → H2SO4 Кислотные оксиды
- 10. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
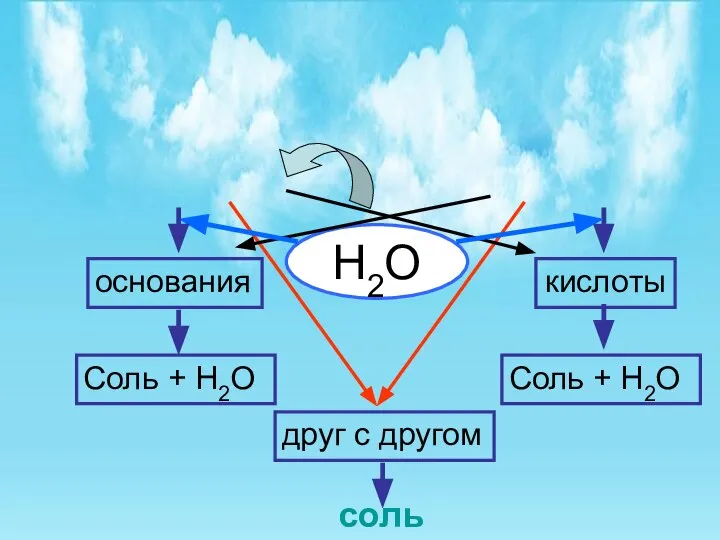
- 11. Н2О Соль + Н2О Соль + Н2О друг с другом соль основания кислоты
- 12. Амфотерные Оксиды. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
- 13. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 14. Вывод. С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
- 15. Газ, необходимый растениям для фотосинтеза Содержание углекислого газа в атмосфере относительно невелико, всего 0,04—0,03%. В воздухе,
- 16. Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе
- 17. Cухой лед – тоже CO2 Сухой лед в отличие от водяного льда плотный. Он тонет в
- 18. Оксид хрома(III) – Cr2O3 –кристаллы зеленого цвета, нерастворимые в воде. Cr2O3 используют как пигмент при изготовлении
- 19. Оксид магния MgO Оксид магния – основный оксид. Магниевая лента, вступив в реакцию с кислородом воздуха,
- 20. Оксид кремния (IV) SiO2 Плиний считал, что горный хрусталь «рождается из небесной влаги и чистейшего снега».
- 21. Оксид цинка ZnO – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила). Цинковыми
- 22. Задания. Определите характер данных оксидов CO2, ZnO, Na2O, SO2, CaO, NO и напишите соответствующие им гидроксиды.
- 24. Скачать презентацию




















 Презентация по Химии "История развития химии" - скачать смотреть
Презентация по Химии "История развития химии" - скачать смотреть  Строение атома Подготовка к ЕГЭ
Строение атома Подготовка к ЕГЭ Производство каустической соды Дисциплина: Технология химических производств
Производство каустической соды Дисциплина: Технология химических производств Негосударственное образовательное учреждение частная школа «Радуга» Исследование чипсов Выполнил Ученик 10класса Борзов Ден
Негосударственное образовательное учреждение частная школа «Радуга» Исследование чипсов Выполнил Ученик 10класса Борзов Ден Химический элемент цинк
Химический элемент цинк Кислородсодержащие органические соединения. Предельные одноатомные спирты
Кислородсодержащие органические соединения. Предельные одноатомные спирты Энергетика химических процессов
Энергетика химических процессов Обмен аминокислот и белков
Обмен аминокислот и белков Разработка и добыча нефти и газа. (Тема 1.5)
Разработка и добыча нефти и газа. (Тема 1.5) Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно
Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно Спирты. Классификация, номенклатура, изомерия. Спирты в природе
Спирты. Классификация, номенклатура, изомерия. Спирты в природе Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья
Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья  Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Презентация по Химии "Классификация химических реакций" - скачать смотреть
Презентация по Химии "Классификация химических реакций" - скачать смотреть  Кислород, его получение и физ свойства
Кислород, его получение и физ свойства Экзогенная серия. Группа выветривания
Экзогенная серия. Группа выветривания Цинк (Zn). Свойства
Цинк (Zn). Свойства Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов Подготовка к ЕГЭ
Подготовка к ЕГЭ Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2)
Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) Строение атома азота
Строение атома азота Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Презентация по Химии "Чугуны. Классификация" - скачать смотреть
Презентация по Химии "Чугуны. Классификация" - скачать смотреть  Метаморфогенные месторождения
Метаморфогенные месторождения Оксиды. Физические свойства
Оксиды. Физические свойства