Содержание
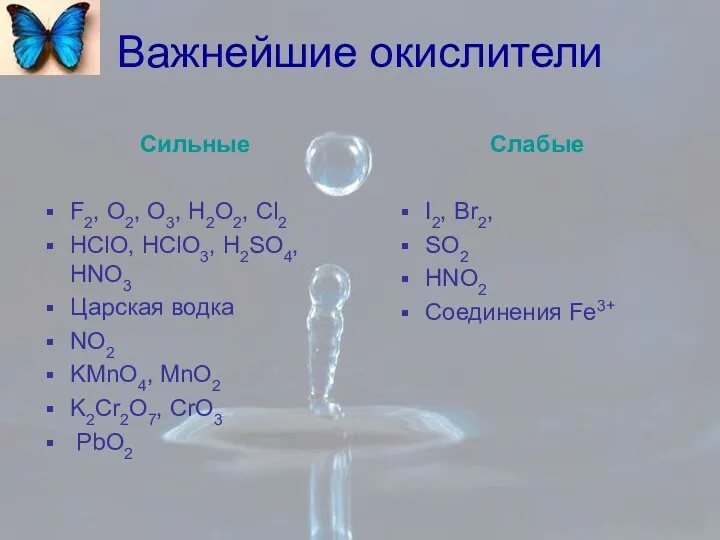
- 2. Важнейшие окислители Сильные F2, O2, O3, H2O2, Cl2 HClO, HClO3, H2SO4, HNO3 Царская водка NO2 KMnO4,
- 3. Сильные Щелочные и щелочно-земельные металлы Mg, Al, H2 HI и йодиды HBr и бромиды H2S и
- 4. Составление уравнений окислительно-восстановительных реакций Метод электронного баланса применяется при рассмотрении ОВР, протекающих при: сплавлении веществ, термическом
- 5. Ионно-электронный метод Достоинства метода В нем применяются не гипотетические ионы, а реально существующие ( не Mn7+,
- 6. Ионно-электронный метод Избыток ионов О2- связывается: в кислой среде – ионами Н+ О2- + 2Н+ →
- 7. Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия
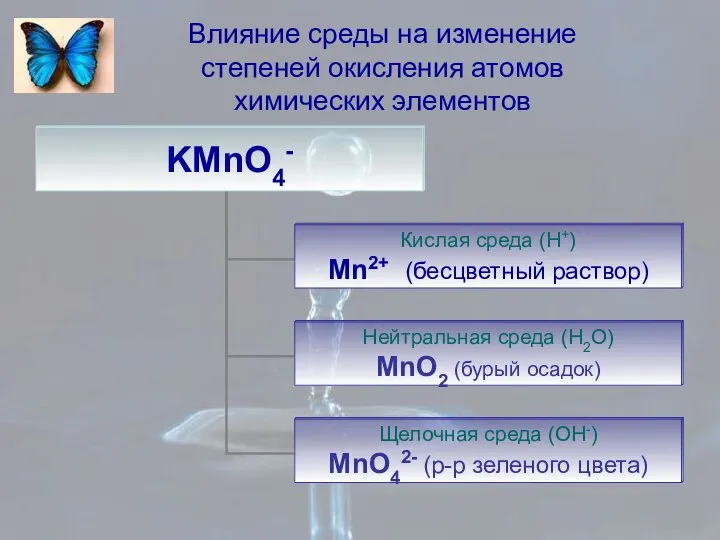
- 8. Влияние среды на изменение степеней окисления атомов химических элементов
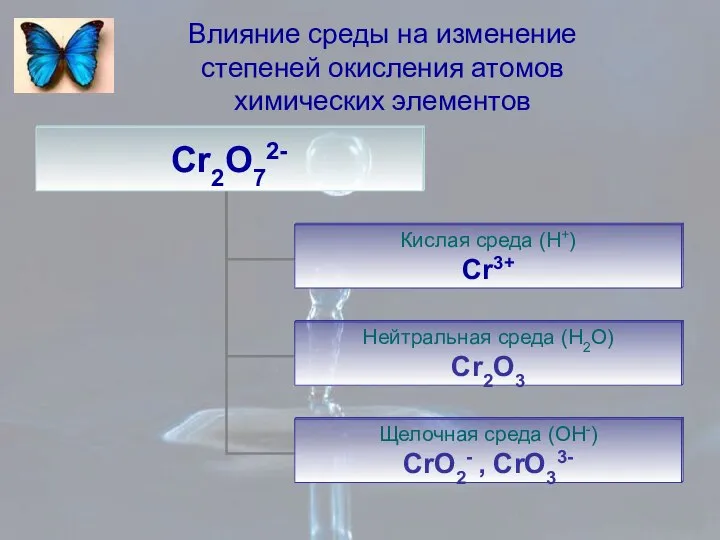
- 9. Влияние среды на изменение степеней окисления атомов химических элементов
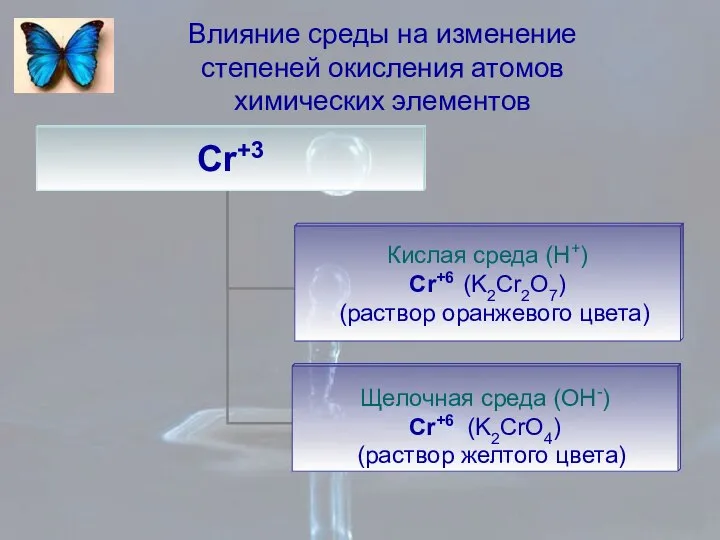
- 10. Влияние среды на изменение степеней окисления атомов химических элементов
- 11. Влияние среды на изменение степеней окисления атомов химических элементов
- 13. Скачать презентацию






 Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии
Арены. Бензол. Среди 22 миллионов органических соединений немного найдется таких , которые оказали на развитие органической химии  Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов.  Алюминий - презентация скачать
Алюминий - презентация скачать  Радиоактивные превращения . Закон радиоактивного распада.
Радиоактивные превращения . Закон радиоактивного распада. Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку ОКСИДЫ АЗОТА.
ОКСИДЫ АЗОТА. Металлы. Разнообразие металлов
Металлы. Разнообразие металлов Mendel and the Gene Idea
Mendel and the Gene Idea Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович
Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович Химия неметаллов
Химия неметаллов Углеводы
Углеводы Гликоген(C6H10O5)n, полисахарид, образованный остатками глюкозы
Гликоген(C6H10O5)n, полисахарид, образованный остатками глюкозы Linear form of polyphenylsilsesquioxanes
Linear form of polyphenylsilsesquioxanes Защита населения от воздействия аварийно химически опасных веществ
Защита населения от воздействия аварийно химически опасных веществ Комплексні сполуки
Комплексні сполуки  Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Основы органической химии
Основы органической химии Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Рефрактометрия как экспресс-метод определения лекарственных средств
Рефрактометрия как экспресс-метод определения лекарственных средств Загальна характеристика гормонів
Загальна характеристика гормонів Измерительные приборы.
Измерительные приборы.  Общие понятия и определения опасных химических веществ. Модуль 1.1
Общие понятия и определения опасных химических веществ. Модуль 1.1 Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Классификация автомобильных масел
Классификация автомобильных масел Periodic Table of the Elements
Periodic Table of the Elements Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Общая характеристика ферментов как биологических катализаторов
Общая характеристика ферментов как биологических катализаторов