Содержание
- 2. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА Выполним задание « Найди родственников» Из перечня формул составьте генетический ряд.(вопросы…) Ca(OH)2, CI2,
- 3. Общий вывод: Признаки которые характеризуют генетический ряд: Вещества разных классов; Разные вещества образованные одним химическим элементом,
- 4. Вспомним … 1.Валентность. 2.Степень окисления. 3.Восстановитель. 4.Окислитель. 5.Типы химических реакций.
- 5. Окислительно –восстановительные Реакции
- 6. Цель урока: 1.Сформировать понятие об окислительно-восстановительных реакциях. 2.Научиться уравнивать записи ОВР методом электронного баланса.
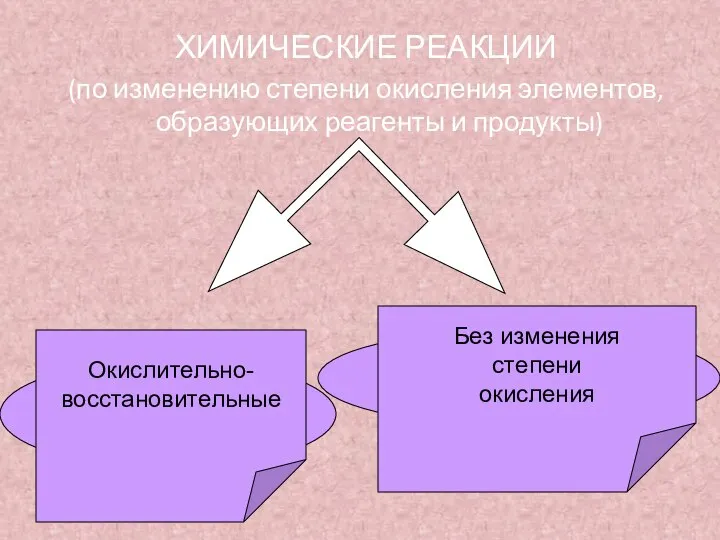
- 7. ХИМИЧЕСКИЕ РЕАКЦИИ (по изменению степени окисления элементов, образующих реагенты и продукты) +1 +5 -2 +1-1 +1
- 8. ХИМИЧЕСКИЕ РЕАКЦИИ, В РЕЗУЛЬТАТЕ КОТОРЫХ ПРОИСХОДИТ ИЗМЕНЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ ИЛИ ИОНОВ, ОБРАЗУЮЩИХ РЕАГИРУЮЩИЕ
- 9. Ar +18 ) ) ) Ar0 2 8 8 Ca0 +20 ) ) ) ) Ca2+
- 10. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
- 11. Отдает или принимает? S+6 ? S0 S+6 ? S-2 S+4 ? S+6 S-2 ? S+4 Cu0
- 12. Восстановление – процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается Cl0 +
- 13. Cl0 + 1e → Cl-1 атом хлора ион хлора Cu+2 + 2e → Cu0 ион меди
- 14. Окисление- процесс отдачи электронов атомами, ионами или молекулами. Степень окисления при этом повышается Na0 – 1e
- 15. Al0 – 3e → Al+3 атом ион алюминия алюминия S-2 - 2e → S0 сульфид-ион атом
- 17. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления
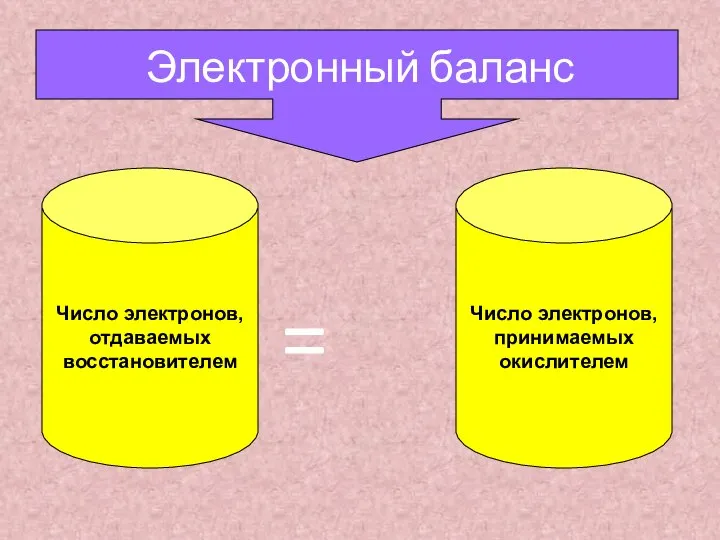
- 18. Электронный баланс = Число электронов, отдаваемых восстановителем Число электронов, принимаемых окислителем
- 19. Метод электронного баланса 1. Над символом каждого элемента напишите его степень окисления (СО) 0 -1 +5
- 20. 0 -1 +5 -2 -1 +6 -2 +4 -2 +1 -2 S + HNO3 → H2SO4
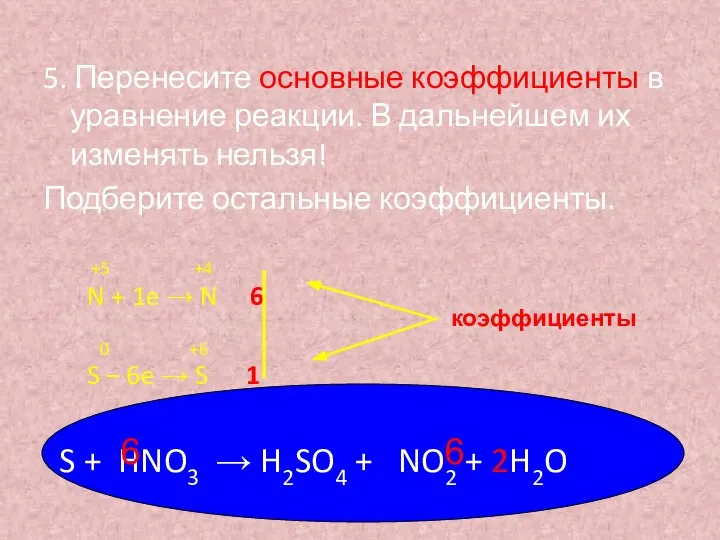
- 21. 4. Сравните число отданных и принятых электронов. Если они не равны, подберите множители к схемам процессов
- 22. 5. Перенесите основные коэффициенты в уравнение реакции. В дальнейшем их изменять нельзя! Подберите остальные коэффициенты. +5
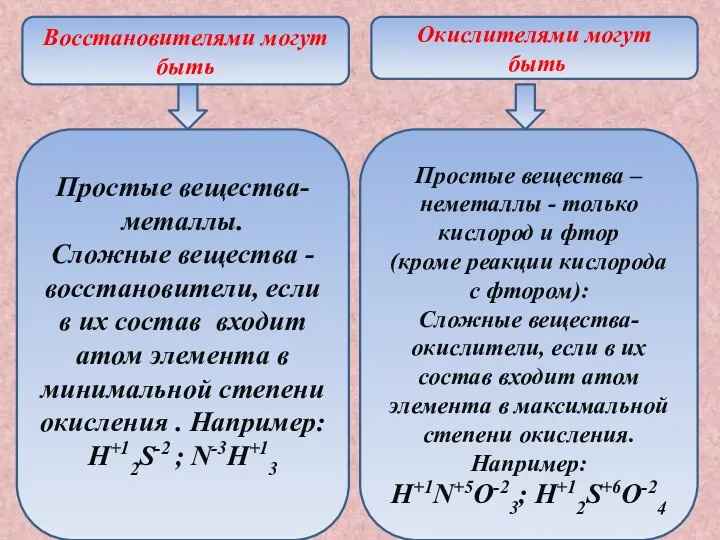
- 23. Восстановителями могут быть Окислителями могут быть Простые вещества-металлы. Сложные вещества - восстановители, если в их состав
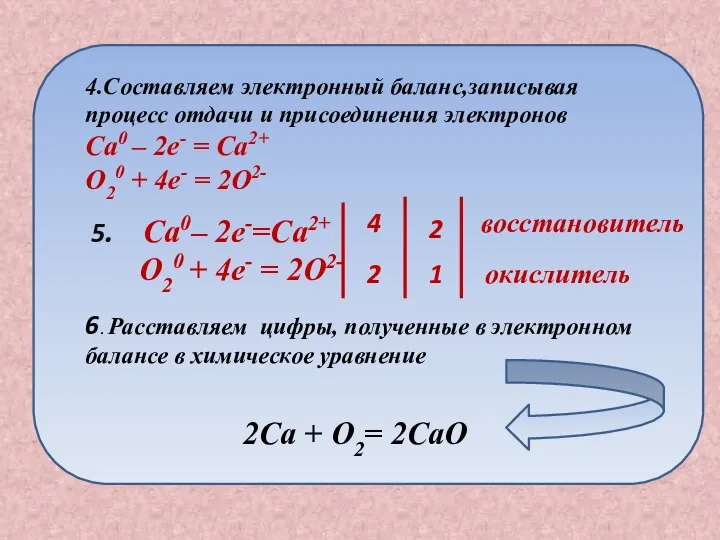
- 24. План составления окислительно -восстановительной реакции Записываем схему химической реакции Ca + O2 2. Расставляем степени окисления
- 25. 5. Ca0– 2e-=Ca2+ O20 + 4e- = 2O2- 4 2 2 1 восстановитель окислитель 6. Расставляем
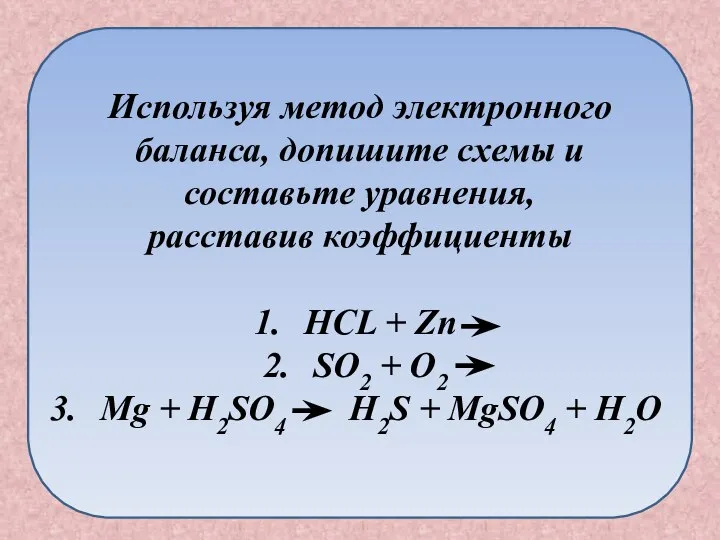
- 26. Используя метод электронного баланса, допишите схемы и составьте уравнения, расставив коэффициенты HCL + Zn SO2 +
- 27. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 29. Скачать презентацию




















 Элементарные процессы роста кристаллов (лекция 2)
Элементарные процессы роста кристаллов (лекция 2) c4bf82f888b84ff1b75efb1a64c84b0f
c4bf82f888b84ff1b75efb1a64c84b0f Получение и реакции пиразина
Получение и реакции пиразина Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Энергетический обмен
Энергетический обмен Правила поведения зимой на воде
Правила поведения зимой на воде  Классы неорганических соединений Оксиды Кислоты Соли Основания
Классы неорганических соединений Оксиды Кислоты Соли Основания Основы промышленной экологии. Занятие 2
Основы промышленной экологии. Занятие 2 Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Ізотопи і нукліди
Ізотопи і нукліди Номенклатура органических веществ - алканов
Номенклатура органических веществ - алканов Своя игра «Знаешь ли ты химические элементы?»
Своя игра «Знаешь ли ты химические элементы?» Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Л3.12 Композицитонные материалы
Л3.12 Композицитонные материалы Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза Полимеры. Классификация, применение
Полимеры. Классификация, применение Значение органической химии Кондрашов Алексей | 9 А класс
Значение органической химии Кондрашов Алексей | 9 А класс  Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Агрохимия растений
Агрохимия растений Штучні і синтетичні волокна
Штучні і синтетичні волокна  Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Релаксационные свойства полимеров
Релаксационные свойства полимеров Роль металлов в нашей жизни
Роль металлов в нашей жизни Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Предмет химии. Вещества
Предмет химии. Вещества Гидролиз солей.
Гидролиз солей.  Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал
Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал