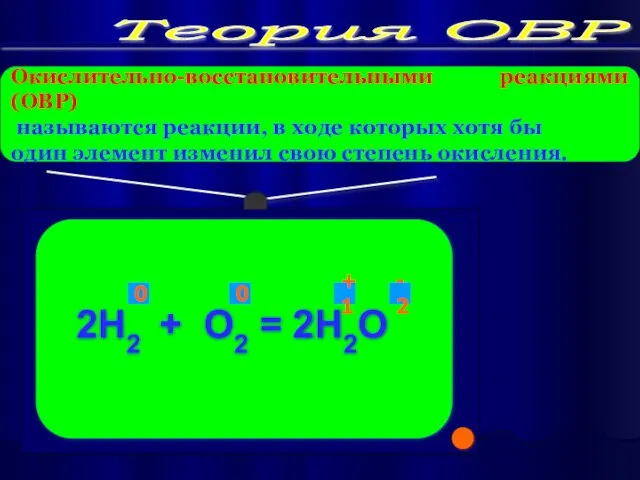
Определить СО элементов до и после реакции.
Подчеркнуть элементы, степени окисления которых
изменяются.
Электронный баланс осуществляем в той части, где:
Есть больше веществ
Если одинаково, то пишем переход в правой части уравнения
Если до реакции есть окислители –O2 ; Cl2 ; Br2 ; F2 ; I2; или восстановитель H2,то переход пишем в левой части.
5. С помощью стрелок показываем переход :
Если CO элемента повышается ,то атом наоборот отдает электроны
Если CO элемента понижается ,то атом наоборот принимает электроны
Находим НОК отданных и принятых электронов
Чтобы расставить коэффициенты НОК делим на число отданных и принятых е
Расставляем оставшиеся коэффициенты
Записываем процессы
Алгоритм составления ОВР







 Органическая химия. Жиры
Органическая химия. Жиры Применение дидактических игр на уроках химии
Применение дидактических игр на уроках химии История чернил
История чернил Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Орбитали и связи
Орбитали и связи Строение атома. Опыты Резерфорда
Строение атома. Опыты Резерфорда Система подготовки к ЕГЭ по математике Рулева Т.Г. МОУ СОШ №42 г. Петрозаводск Республика Карелия
Система подготовки к ЕГЭ по математике Рулева Т.Г. МОУ СОШ №42 г. Петрозаводск Республика Карелия Свойства воды
Свойства воды Нуклеиновые кислоты
Нуклеиновые кислоты Презентація на тему: Твердість води Способи усунення твердості води
Презентація на тему: Твердість води Способи усунення твердості води  Белки. Структуры белков
Белки. Структуры белков Щелочноземельные металлы
Щелочноземельные металлы Автометаморфизм
Автометаморфизм Периодический закон и периодическая система химических элементов д.и.менделеева в свете учения о строении атома
Периодический закон и периодическая система химических элементов д.и.менделеева в свете учения о строении атома Первоначальная периодическая таблица Д.И.Менделеева
Первоначальная периодическая таблица Д.И.Менделеева Кислородосодержащие органические соединения Cпирты (алканолы)
Кислородосодержащие органические соединения Cпирты (алканолы) Виды лабораторной посуды и вспомогательных принадлежностей. Лекция №7
Виды лабораторной посуды и вспомогательных принадлежностей. Лекция №7 Валентность и АМУ
Валентность и АМУ Природный газ и нефть
Природный газ и нефть Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Развивающие занятия в ГПД «Поделочные камни»
Развивающие занятия в ГПД «Поделочные камни» соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю. Виды химической связи
Виды химической связи Метаболизм белков и аминокислот
Метаболизм белков и аминокислот Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Презентация по Химии "Алкены." - скачать смотреть бесплатно_
Презентация по Химии "Алкены." - скачать смотреть бесплатно_ Основные понятия и законы химии
Основные понятия и законы химии Нафта Виконала учениця 11-А класу Ковальова Анастасія
Нафта Виконала учениця 11-А класу Ковальова Анастасія