Содержание
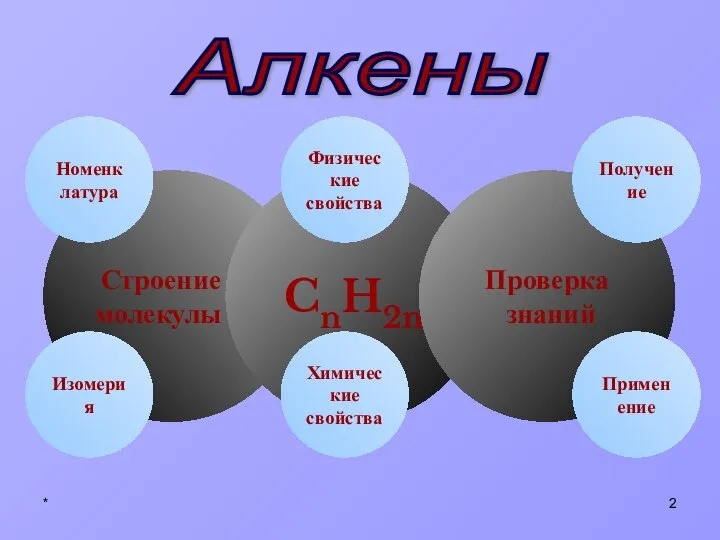
- 2. * Строение молекулы CnH2n Химические свойства Изомерия Физические свойства Проверка знаний Получение Номенклатура Применение Алкены
- 3. * Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между
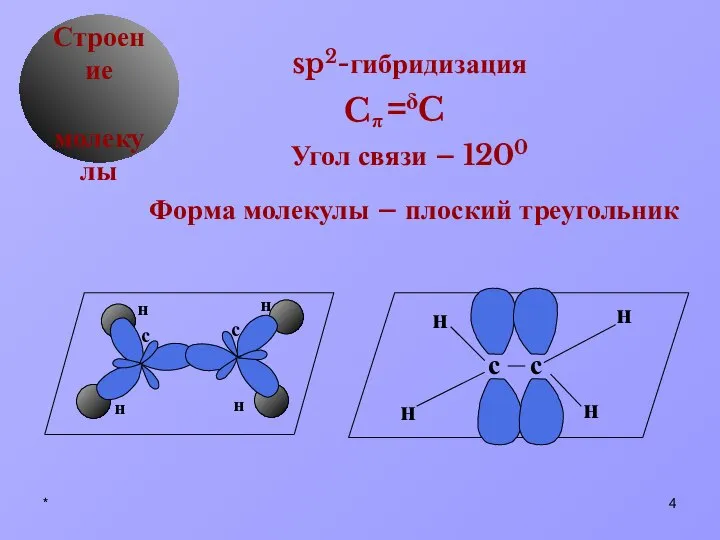
- 4. * δ Строение молекулы sp2-гибридизация Угол связи – 1200 Форма молекулы – плоский треугольник C π
- 5. * Н С Номенклатура 1. Выбор главной цепи. Н Н3 С С С С С СН3
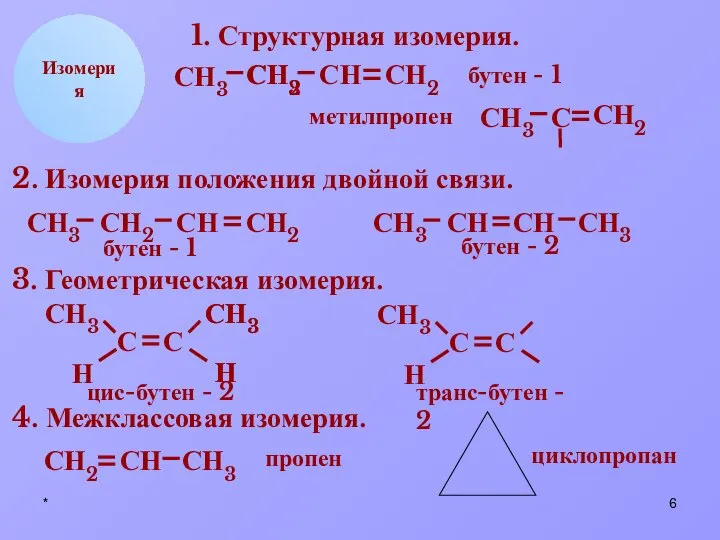
- 6. * СН2 СН СН3 Н Изомерия 1. Структурная изомерия. СН2 СН3 С СН2 СН3 С СН2
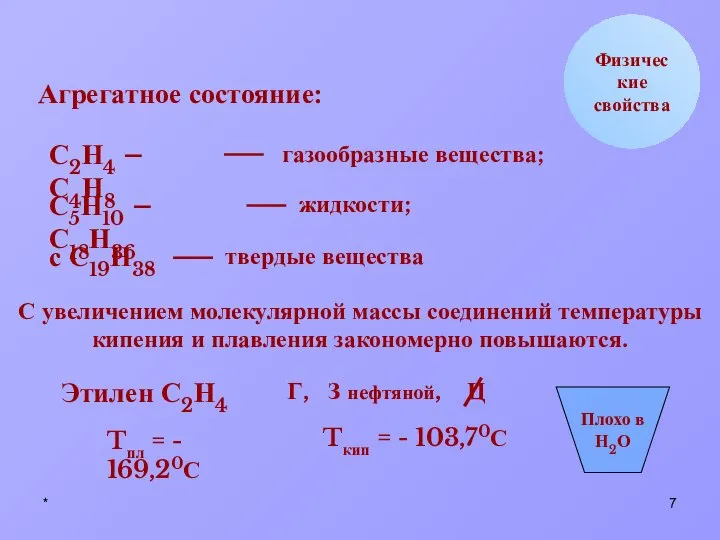
- 7. * Физические свойства Агрегатное состояние: С2Н4 – С4Н8 газообразные вещества; С5Н10 – С18Н36 жидкости; с С19Н38
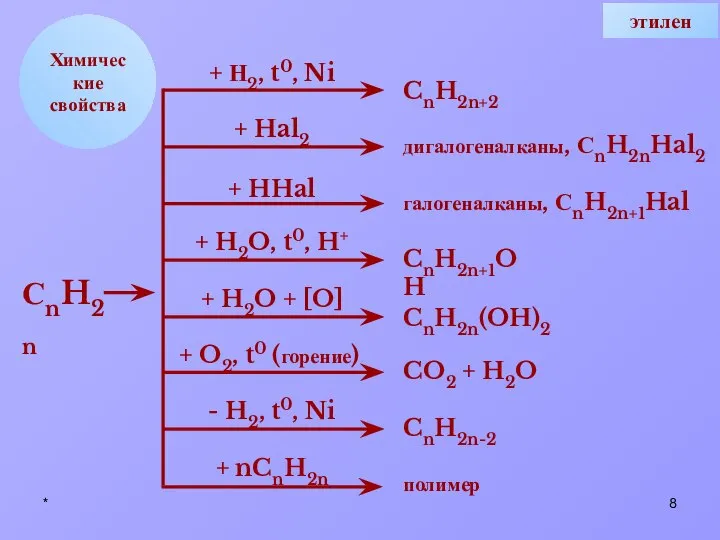
- 8. * Химические свойства + Н2, t0, Ni + Hal2 + HHal + H2O, t0, H+ +
- 9. * СН ОН 4. Гидратация: Pt, t Химические свойства этилена 1. Гидрирование: СН2 СН2 + Н2
- 10. * Br СН2 Получение 1. Крекинг нефтепродуктов: С16Н34 С8Н18 + С8Н16 2. Дегидрирование предельных углеводородов: СН3
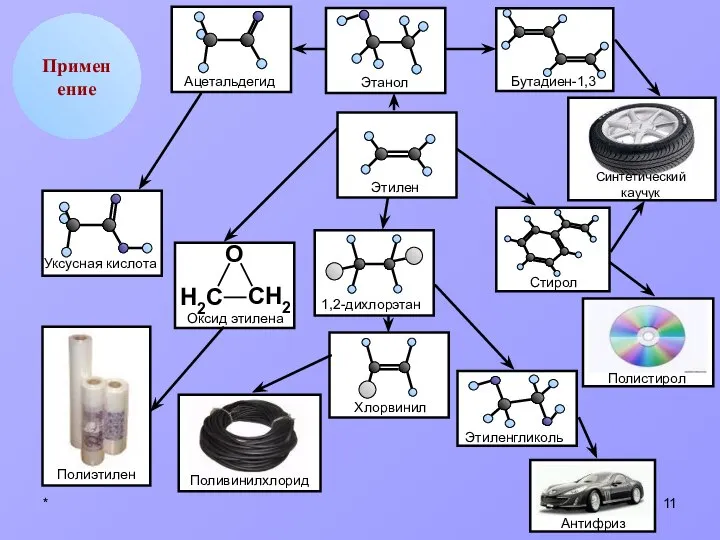
- 11. * Применение
- 13. Скачать презентацию




 Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Атомдар мен молекулалар
Атомдар мен молекулалар Липиды
Липиды Нуклеопротеины
Нуклеопротеины Кислотно-основное титрование. Аналитическая химия
Кислотно-основное титрование. Аналитическая химия Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Метаморфогенные месторождения
Метаморфогенные месторождения Химия в медицине
Химия в медицине Увеличение эффективности печи установки АТ
Увеличение эффективности печи установки АТ Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5)
Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5) Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Презентация Палладий
Презентация Палладий  Стеклопластики. Типы стеклопластиков и их классификация
Стеклопластики. Типы стеклопластиков и их классификация 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Влияние соли
Влияние соли Коррозия металлов
Коррозия металлов Мінерали та гірські породи
Мінерали та гірські породи Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В.
Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В. Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА
Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА  Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин)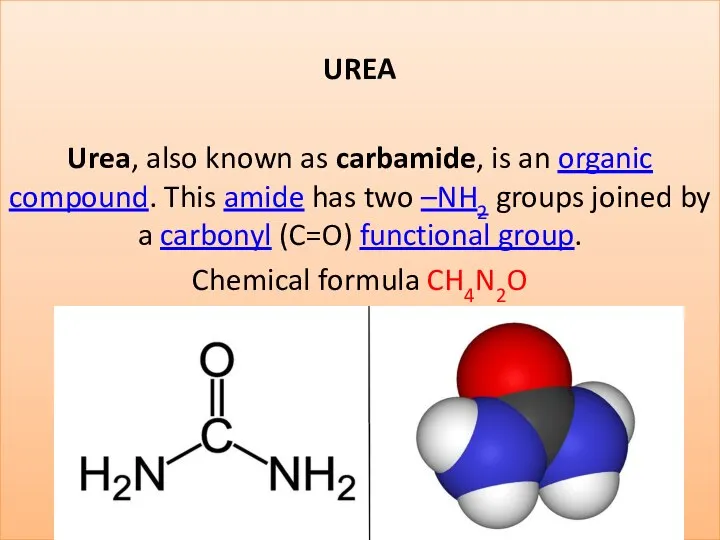 Urea (carbamide)
Urea (carbamide) Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии