Содержание
- 2. Окислительно-восстановительные реакции (ОВР) – это реакции, в процессе которых меняется степень окисления двух элементов, один из
- 3. Правила составления (алгоритм) окислительно – восстановительных реакций (ОВР)
- 4. CuS+HNO3→Cu(NO3)2+ S + NO+H2O 1. Запишем уравнение реакции 2. Расставим степени окисления всех элементов Cu+2S-2 +H+1N+5O-23→Cu+2(N+5O-23)-12+
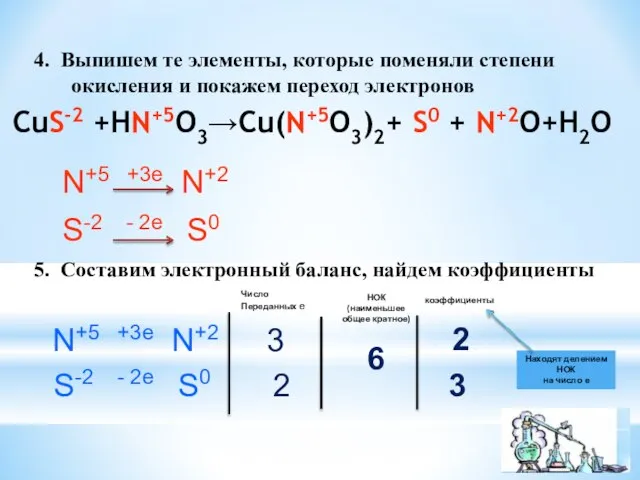
- 5. 4. Выпишем те элементы, которые поменяли степени окисления и покажем переход электронов CuS-2 +HN+5O3→Cu(N+5O3)2+ S0 +
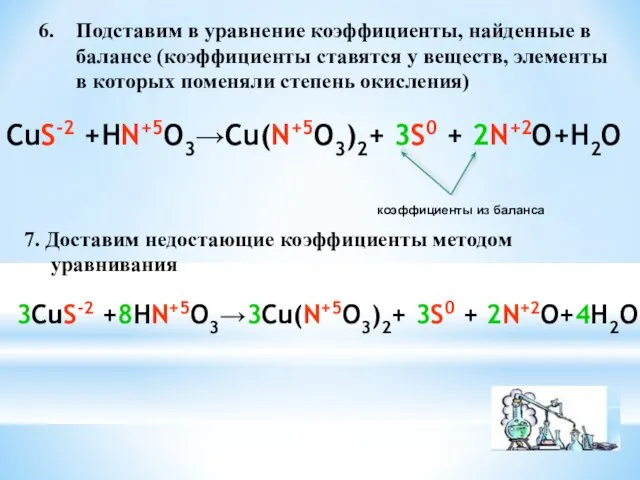
- 6. Подставим в уравнение коэффициенты, найденные в балансе (коэффициенты ставятся у веществ, элементы в которых поменяли степень
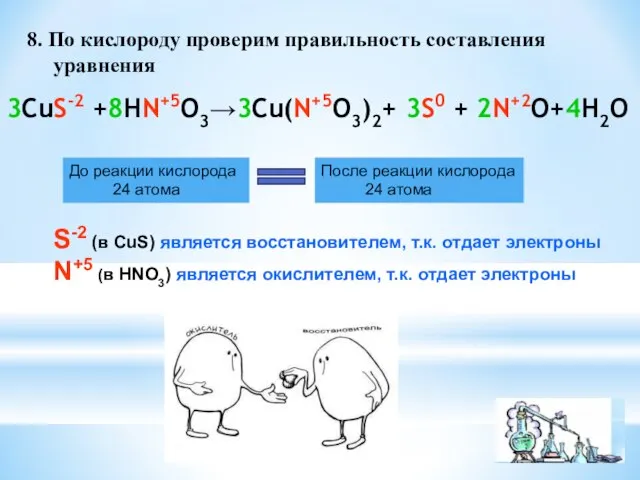
- 7. 8. По кислороду проверим правильность составления уравнения 3CuS-2 +8HN+5O3→3Cu(N+5O3)2+ 3S0 + 2N+2O+4H2O До реакции кислорода 24
- 8. Составим уравнение окислительно-восстановительной реакции Mg+H2SO4→MgSO4+ H2S + H2O 4Mg0+5H2+1 S+6O4-2→4Mg+2S+6O4-2+ H2+1S-2 + 4H2+1O-2 S+6 + 8e
- 9. Тест Вопрос № 1 Какое уравнение соответствует окислительно-восстановительной реакции? CaCO3= CaO + CO2 BaCl2 + Na2SO4
- 11. Скачать презентацию





 Правила работы и основные методы исследований в химической лаборатории
Правила работы и основные методы исследований в химической лаборатории Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Цикл три і дикарбонових кислот (Цикл Кребса)
Цикл три і дикарбонових кислот (Цикл Кребса) Радиоуглеродный метод
Радиоуглеродный метод Урок химии на тему: «Типы химических реакций»
Урок химии на тему: «Типы химических реакций» Строение атома. (8 класс)
Строение атома. (8 класс) Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Э.М. Спиридонов. Эволюция минералов кадмия в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов кадмия в зоне гипергенеза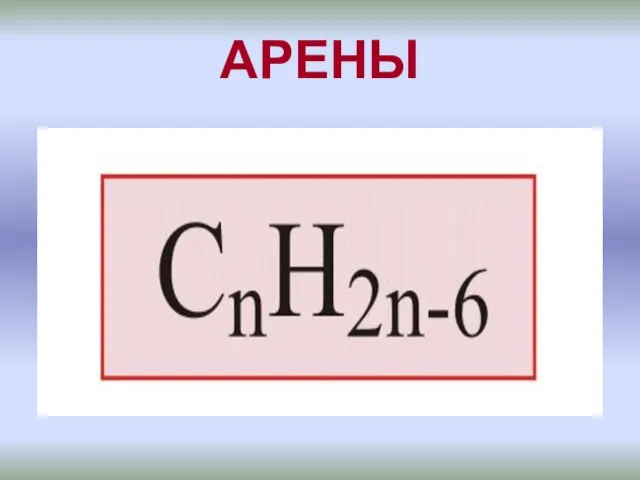 Бензоидные ароматические углеводороды - арены
Бензоидные ароматические углеводороды - арены Нефть. Образование нефти
Нефть. Образование нефти ХІМІЯ ТА ЕКОЛОГІЯ ПЛАНЕТАРНА РОЛЬ ХІМІЧНИХ ПРОЦЕСІВ Смерека Б.А. ЛЗШ №43
ХІМІЯ ТА ЕКОЛОГІЯ ПЛАНЕТАРНА РОЛЬ ХІМІЧНИХ ПРОЦЕСІВ Смерека Б.А. ЛЗШ №43 Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов
Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов Биопластики: область применения
Биопластики: область применения Липиды
Липиды Биополимеры: естественные и искусственные
Биополимеры: естественные и искусственные Кислоты. Состав кислот
Кислоты. Состав кислот Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Білки
Білки  Литий. Общая характеристика элементов подгруппы 1А
Литий. Общая характеристика элементов подгруппы 1А You must match the right definition or word in your bingo board if you finish all say Bingo
You must match the right definition or word in your bingo board if you finish all say Bingo Материаловедение и методы диагностики микро- и наноструктурных материалов
Материаловедение и методы диагностики микро- и наноструктурных материалов Substancje chemiczne
Substancje chemiczne ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ПРИРОДНЫХ ЭНЕРГОНОСИТЕЛЕЙ И УГЛЕРОДНЫХ МАТЕРИАЛОВ Преподаватель Левашова Альбина Ивановна, к.т.н. Франци
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ПРИРОДНЫХ ЭНЕРГОНОСИТЕЛЕЙ И УГЛЕРОДНЫХ МАТЕРИАЛОВ Преподаватель Левашова Альбина Ивановна, к.т.н. Франци Химия и пища
Химия и пища Презентация по Химии "Природня родина: Лужноземельні." - скачать смотреть бесплатно
Презентация по Химии "Природня родина: Лужноземельні." - скачать смотреть бесплатно ХИМИЯ КАК СРЕДСТВО ОСМЫСЛЕНИЯ РЕАЛЬНОЙ ЕДИНОЙ КАРТИНЫ МИРА
ХИМИЯ КАК СРЕДСТВО ОСМЫСЛЕНИЯ РЕАЛЬНОЙ ЕДИНОЙ КАРТИНЫ МИРА Презентация по Химии "Основания." - скачать смотреть бесплатно
Презентация по Химии "Основания." - скачать смотреть бесплатно Геохимия редкоземельных элементов
Геохимия редкоземельных элементов