Содержание
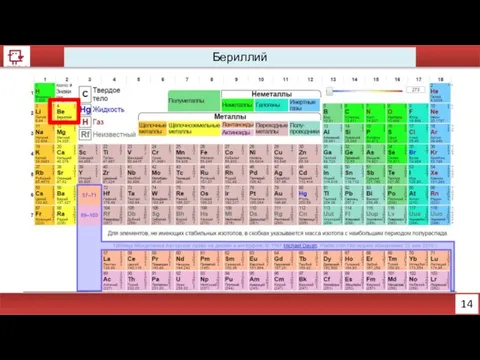
- 2. 14 Бериллий
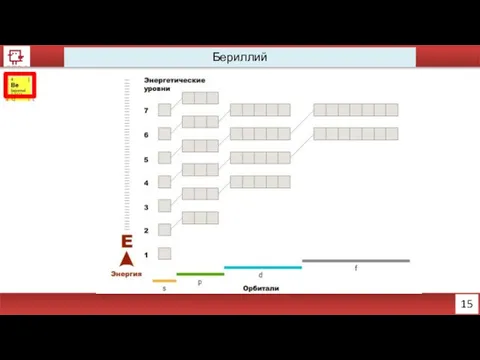
- 3. 15 Бериллий
- 4. 16 Бериллий Количество электронов на внешнем уровне - 1 Радиус - 112 пм Валентность - 2
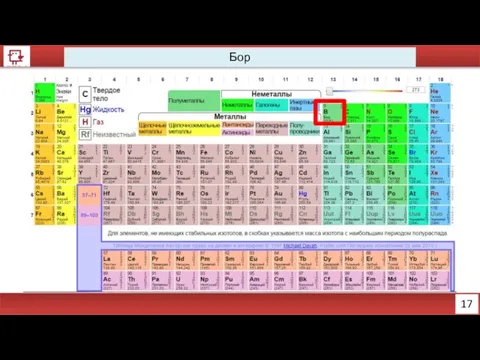
- 5. 17 Бор
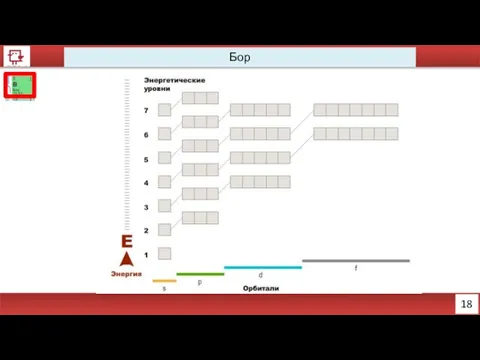
- 6. 18 Бор
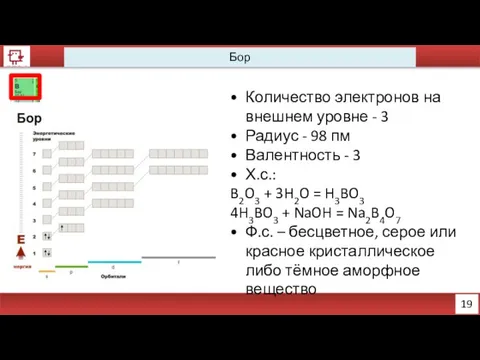
- 7. 19 Бор Количество электронов на внешнем уровне - 3 Радиус - 98 пм Валентность - 3
- 8. 20 Углерод
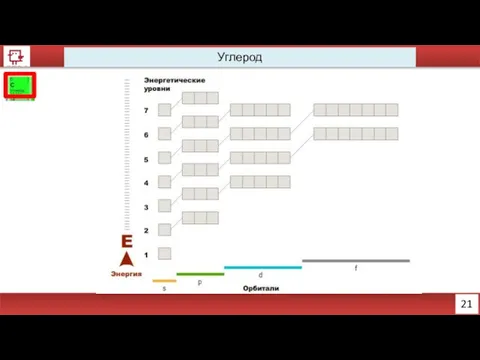
- 9. 21 Углерод
- 10. 22 Углерод Количество электронов на внешнем уровне - 4 Радиус - 91 пм Валентность – 2,
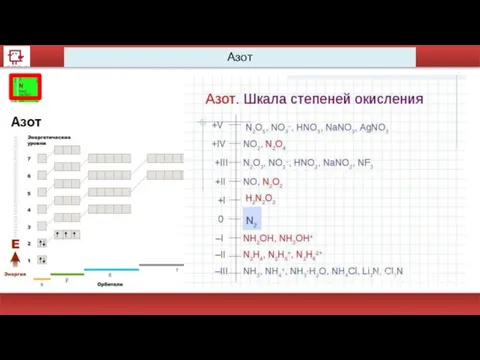
- 11. 23 Азот
- 12. 24 Азот
- 13. Азот Количество электронов на внешнем уровне - 5 Радиус - 92 пм Валентность – 3, 4
- 14. Азот
- 15. Степени окисления Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют
- 16. Азот
- 17. Кислород
- 18. Кислород Количество электронов на внешнем уровне - 6 Радиус - 92 пм Валентность – 2 Х.с.:
- 19. Какое это соединение?
- 20. 31 Фтор
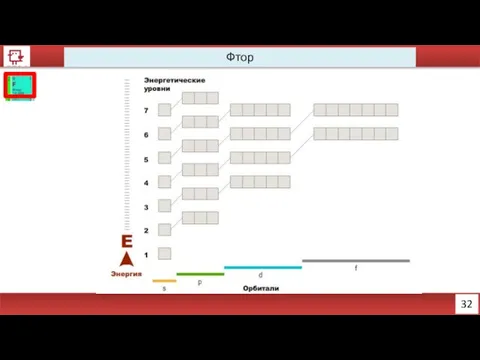
- 21. 32 Фтор
- 22. 33 Фтор Количество электронов на внешнем уровне - 7 Радиус - 73 пм Валентность – 1
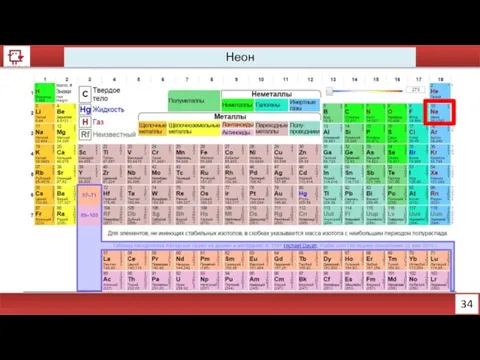
- 23. 34 Неон
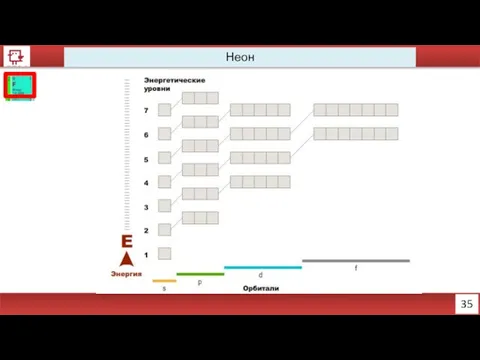
- 24. 35 Неон
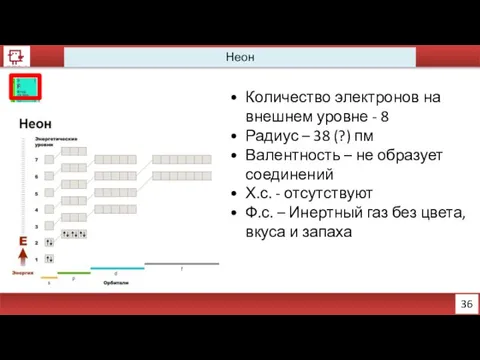
- 25. 36 Неон Количество электронов на внешнем уровне - 8 Радиус – 38 (?) пм Валентность –
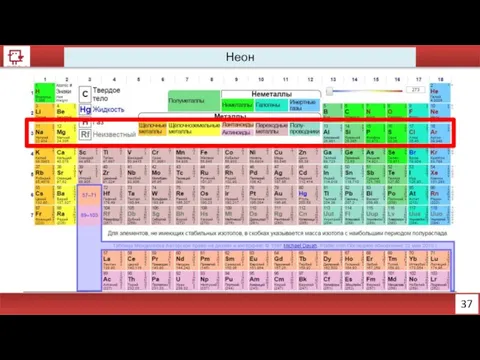
- 26. 37 Неон
- 27. 38 Натрий
- 28. 39 Магний
- 29. 40 Алюминий
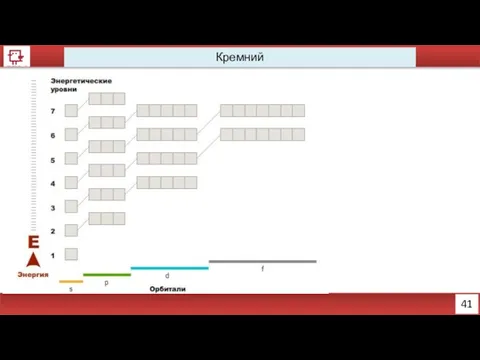
- 30. 41 Кремний
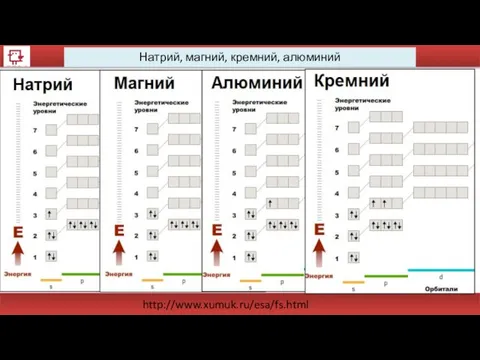
- 31. Натрий, магний, кремний, алюминий http://www.xumuk.ru/esa/fs.html
- 32. Урок 8 класса Типы химической связи.
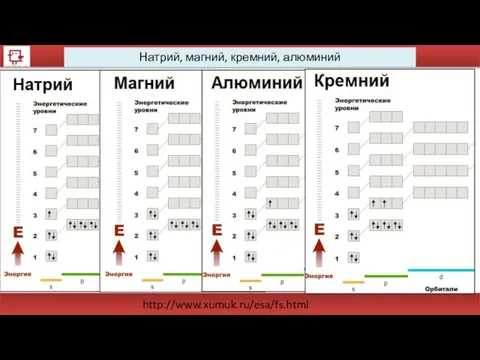
- 33. Натрий, магний, кремний, алюминий http://www.xumuk.ru/esa/fs.html
- 34. Химическая связь Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая
- 35. Химическая связь Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Наоборот, неметаллические
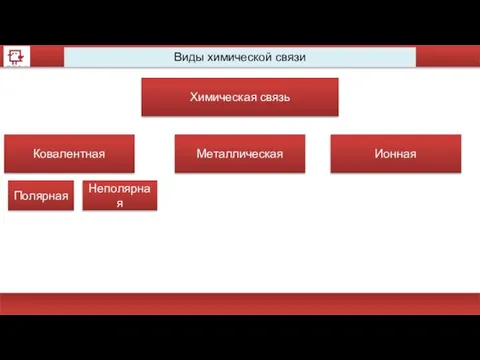
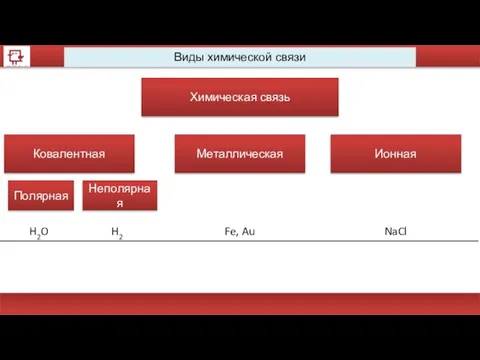
- 36. Виды химической связи Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная
- 37. Виды химической связи Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная H2O H2 Fe, Au NaCl
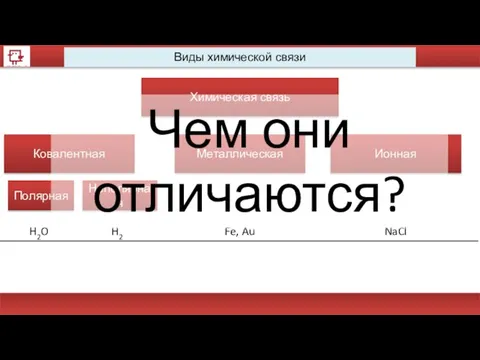
- 38. Виды химической связи Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная H2O H2 Fe, Au NaCl Чем
- 39. Электроотрицательность Электроотрицательность – свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в
- 40. Виды химической связи Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная H2O H2 Fe, Au NaCl 1.24
- 41. Ковалентная связь Химическая связь Ковалентная Металлическая Ионная Полярная Неполярная H2O H2 Fe, Au NaCl 1.24 0
- 42. Ковалентная связь Ковалентная связь – это связь, образующуюся между атомами с одинаковой или близкой электроотрицательностью. В
- 43. Ковалентная связь При образовании ковалентной связи атомы объединяют свои электроны в общую орбиталь, которая формируется из
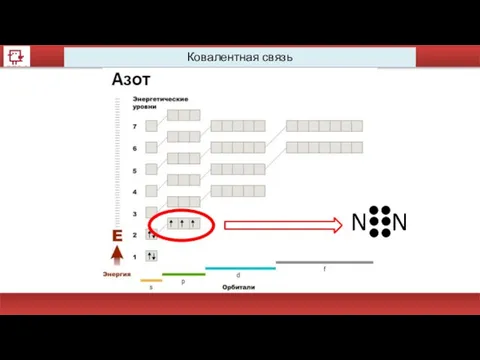
- 44. Ковалентная связь N N
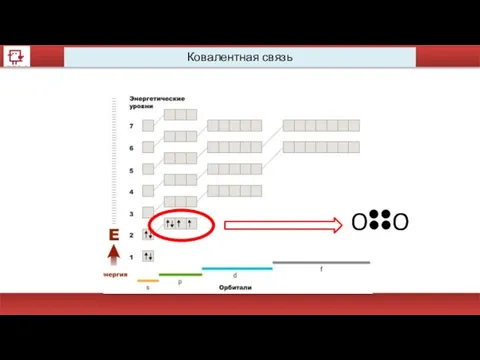
- 45. Ковалентная связь O O
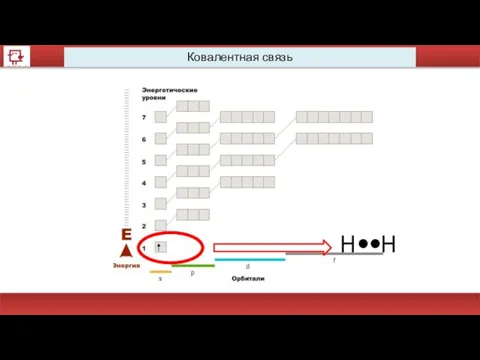
- 46. Ковалентная связь H H
- 47. Ковалентная связь Химическая связь – это взаимодействие атомов, в результате которого образуются устойчивые молекулы или кристаллы.
- 48. Ковалентная связь Химическая связь – это взаимодействие атомов, в результате которого образуются устойчивые молекулы или кристаллы.
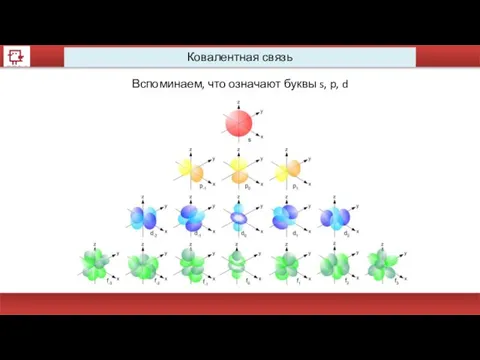
- 49. Ковалентная связь Вспоминаем, что означают буквы s, p, d
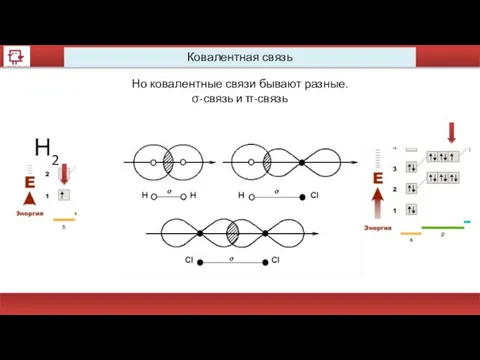
- 50. Ковалентная связь Но ковалентные связи бывают разные. σ-связь и π-связь Н2
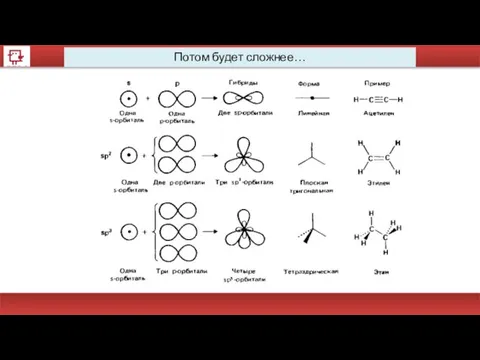
- 51. Потом будет сложнее…
- 52. Полярная и неполярная… Ковалентную химическую связь, которая образуется между атомами с одинаковой электроотрицательностью, называют ковалентной неполярной
- 53. Валентность Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими
- 54. Ковалентная связь Химическая связь Ковалентная Металлическая Ионная H2O H2 Fe, Au NaCl 1.24 0 0 2.23
- 55. Ионная связь. Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения
- 56. Ионная связь. Ионная связь образуется при взаимодействии атомов элементов, электроотрицательности которых резко различаются. Электроны почти полностью
- 57. Ионная связь. Ионная связь образуется при взаимодействии атомов элементов, электроотрицательности которых резко различаются. Электроны почти полностью
- 58. Ионная связь. Химическую связь, возникающую между ионами в результате действия электростатических сил притяжения, называют ионной связью.
- 59. Степени окисления Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют
- 60. Ковалентная связь Химическая связь Ковалентная Металлическая Ионная H2O H2 Fe, Au NaCl 1.24 0 0 2.23
- 62. Скачать презентацию



























 Презентація на тему “Дмитро Іванович Менделєєв”
Презентація на тему “Дмитро Іванович Менделєєв”  Сера и её свойства
Сера и её свойства Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Горные породы
Горные породы Основные классы неорганических веществ
Основные классы неорганических веществ Коррозия металлов
Коррозия металлов Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5)
Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5) Вуглеводи
Вуглеводи Любимый Алюминий
Любимый Алюминий Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Галогены
Галогены Углеводы. Химические свойства
Углеводы. Химические свойства X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ  Презентация по Химии "Генетические связи между классами неорганических веществ" - скачать смотреть бесплатно
Презентация по Химии "Генетические связи между классами неорганических веществ" - скачать смотреть бесплатно Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение
Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение  Анализ ЕГЭ по химии 2011
Анализ ЕГЭ по химии 2011 Презентация по Химии "Простые вещества - неметаллы." - скачать смотреть бесплатно_
Презентация по Химии "Простые вещества - неметаллы." - скачать смотреть бесплатно_ Химическая посуда и её назначение (3)
Химическая посуда и её назначение (3) Философы химии Кант и Гегель
Философы химии Кант и Гегель Презентация АТОМНАЯ ЭНЕРГЕТИКА
Презентация АТОМНАЯ ЭНЕРГЕТИКА Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Презентация по Химии "Свойства полимеров" - скачать смотреть бесплатно
Презентация по Химии "Свойства полимеров" - скачать смотреть бесплатно Обобщение и систематизация знаний по теме «Спирты и фенолы»
Обобщение и систематизация знаний по теме «Спирты и фенолы» Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения Основные понятия органической химии
Основные понятия органической химии