Содержание
- 2. План Понятия окисление, восстановление, окислитель, восстановитель Метод электронного баланса Важнейшие окислители и восстановители Взаимодействие кислот с
- 4. Метод электронного баланса Составляем схему уравнения Указываем изменение степеней окисления элементов Составляем электронные уравнения, указываем окислитель,
- 5. Пример электронного баланса 5К2+1S-2 +2K+1Mn+7O4-2 +8H2+1S+6O4-2 = 5S0 + 2Mn+2S+6O4-2 + 6K2+1S+6O4-2 + 8H2+1O-2 5|10 |S-2
- 6. Важнейшие окислители и восстановители
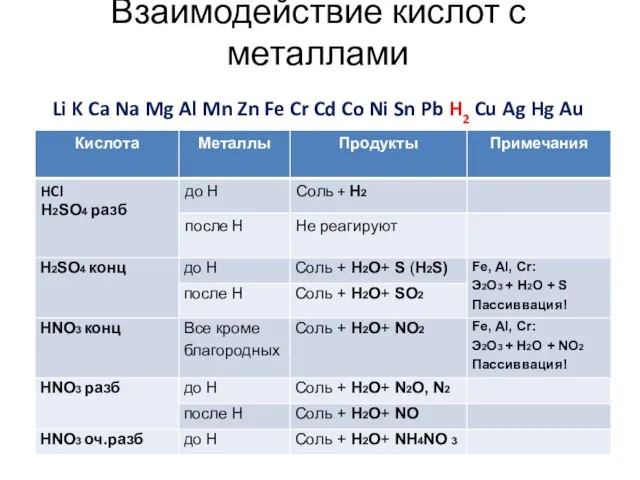
- 7. Взаимодействие кислот с металлами Li K Ca Na Mg Al Mn Zn Fe Cr Cd Co
- 8. Задание: 1. приведите продукты реакций; 2. уравняйте реакции методом электронного баланса; 3. укажите окислитель и восстановитель.
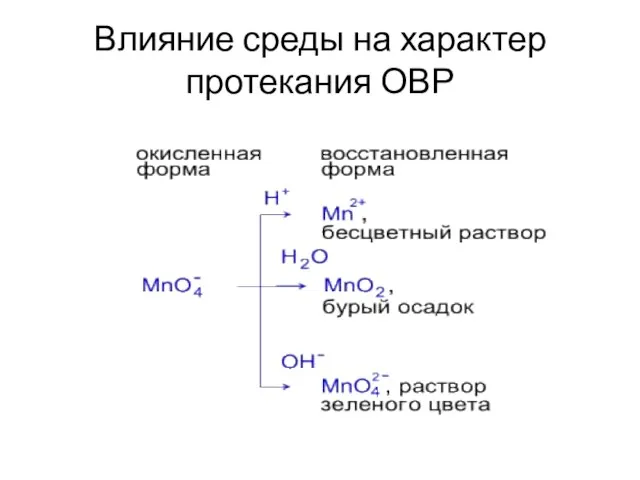
- 9. Влияние среды на характер протекания ОВР
- 10. Задание: 1. приведите схему реакций; 2. уравняйте реакции методом электронного баланса; 3. укажите окислитель и восстановитель.
- 11. Гальванический элемент (химический источник тока)
- 12. План Понятие электродный потенциал Уравнение Нернста Гальванический элемент Якоби-Даниэля Расчет ЭДС гальванического элемента
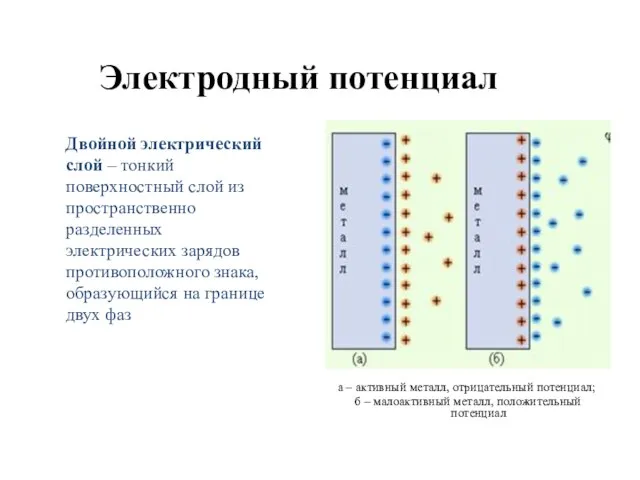
- 13. Электродный потенциал Двойной электрический слой – тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака,
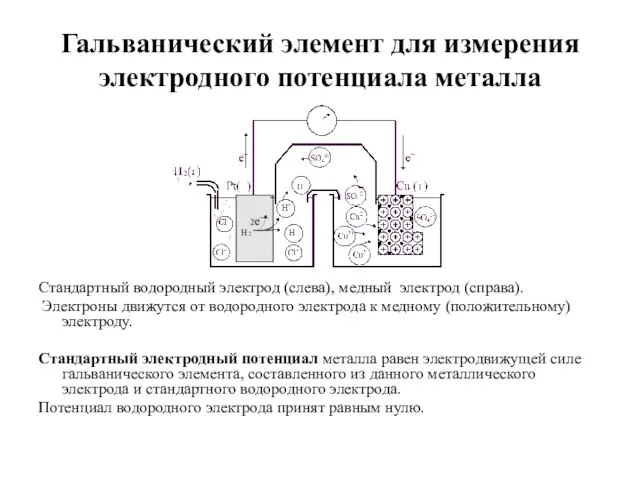
- 14. Гальванический элемент для измерения электродного потенциала металла Стандартный водородный электрод (слева), медный электрод (справа). Электроны движутся
- 15. Уравнение Нернста φ = φº + (RT/nF) ∙ ln[Mn+] φ – электродный потенциал металла, В φº
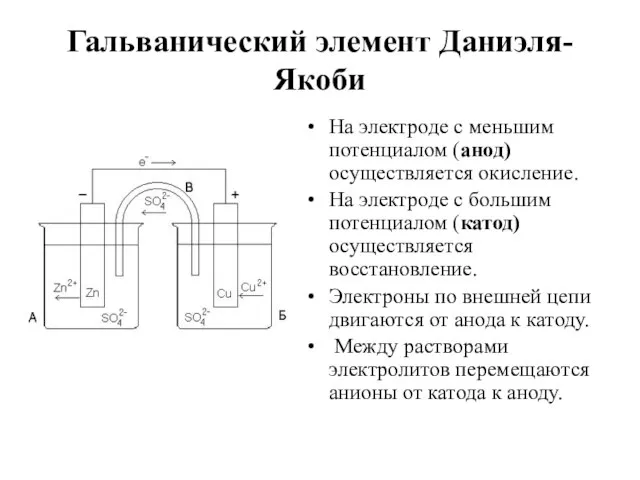
- 16. Гальванический элемент Даниэля-Якоби На электроде с меньшим потенциалом (анод) осуществляется окисление. На электроде с большим потенциалом
- 17. Процесс возможен, если ΔG ΔG = -А ΔG = -n⋅F⋅E A – полезная работа n –
- 18. Пример: Химический источник тока (ХИТ) собран по схеме: Рb| Pb(NO3)2||Sn(NO3)2 |Sn Чему равна ЭДС этого источника,
- 21. Скачать презентацию









![Уравнение Нернста φ = φº + (RT/nF) ∙ ln[Mn+] φ –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/523304/slide-14.jpg)



 Биотрансформация ядов
Биотрансформация ядов Типы химических реакций
Типы химических реакций  Маслянокислые бактерии
Маслянокислые бактерии Ароматические соединения (арены)
Ароматические соединения (арены) Презентация по Химии "Строение Бензола" - скачать смотреть
Презентация по Химии "Строение Бензола" - скачать смотреть  Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла
Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла Алкалоидтар. Алкалоидтар туралы жалпы түсінік
Алкалоидтар. Алкалоидтар туралы жалпы түсінік Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Металлы. Особенности строения атомов металлов и их положения в ПСХЭ. Физические свойства
Металлы. Особенности строения атомов металлов и их положения в ПСХЭ. Физические свойства Життя та наукова діяльність Д.І.Менделєєва
Життя та наукова діяльність Д.І.Менделєєва  Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.
Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе. Урок химии 9 класс Васинева И.Г. АЗОТ
Урок химии 9 класс Васинева И.Г. АЗОТ  Кольцевые силикаты и их аналоги
Кольцевые силикаты и их аналоги Понятия о металлических сплавах. Лекция 4
Понятия о металлических сплавах. Лекция 4 Роль ионов в неживой природе и в жизни людей
Роль ионов в неживой природе и в жизни людей Аттестационная работа. Методика по химии 9 класс «Исследовательская деятельность в решении экспериментальных задач»
Аттестационная работа. Методика по химии 9 класс «Исследовательская деятельность в решении экспериментальных задач» Сопряжение и ароматичность – энергетический фактор стабилизации молекул биологически активных соединений
Сопряжение и ароматичность – энергетический фактор стабилизации молекул биологически активных соединений Кремний. Физический свойства. Получение. Применение
Кремний. Физический свойства. Получение. Применение Электродные материалы для электрохимических систем
Электродные материалы для электрохимических систем Количество вещества Урок изучения нового материала в 8 классе Автор: Ким Н.В. Учитель химии МОУ СОШ №: Г. Нягани ХМАО-Югры Тюм
Количество вещества Урок изучения нового материала в 8 классе Автор: Ким Н.В. Учитель химии МОУ СОШ №: Г. Нягани ХМАО-Югры Тюм Силумины. Виды силуминов
Силумины. Виды силуминов «terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың
«terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Atomic structure and properties. (Chapter 3)
Atomic structure and properties. (Chapter 3) Игра - викторина
Игра - викторина Практическая работа №1. Приготовление растворов с заданной молярной концентрацией
Практическая работа №1. Приготовление растворов с заданной молярной концентрацией Свойства аммиачной селитры
Свойства аммиачной селитры