Содержание
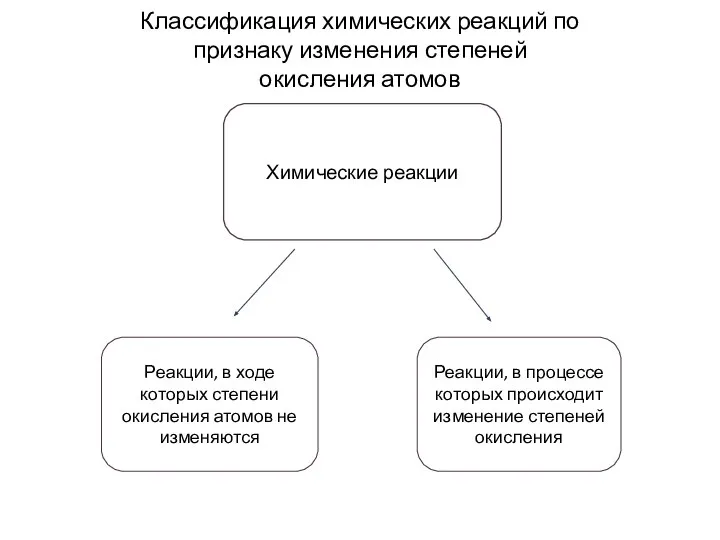
- 2. Химические реакции Классификация химических реакций по признаку изменения степеней окисления атомов
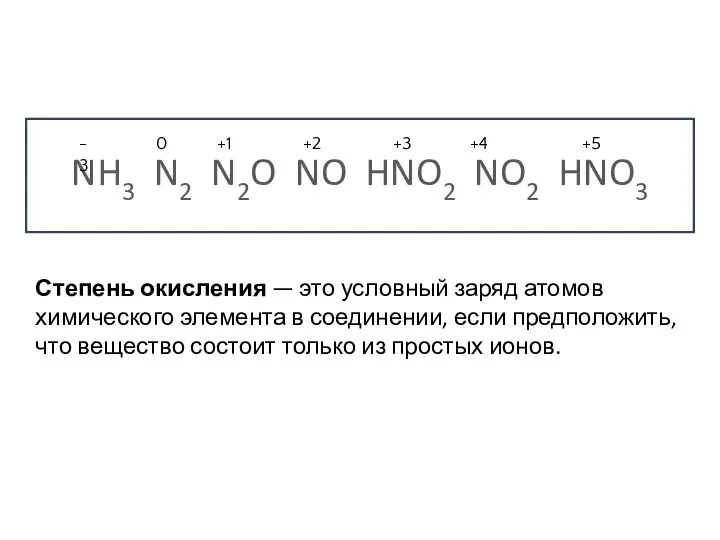
- 3. NH3 N2 N2O NO HNO2 NO2 HNO3 Степень окисления — это условный заряд атомов химического элемента
- 4. Правила расчета степеней окисления: степень окисления кислорода в соединениях -2 (исключения, O-2F2, а также пероксиды, в
- 5. Восстановление — процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается. N +
- 6. Восстановители — атомы, ионы или молекулы, отдающие электроны. Основные восстановители: активные металлы, водород, уголь, оксид углерода
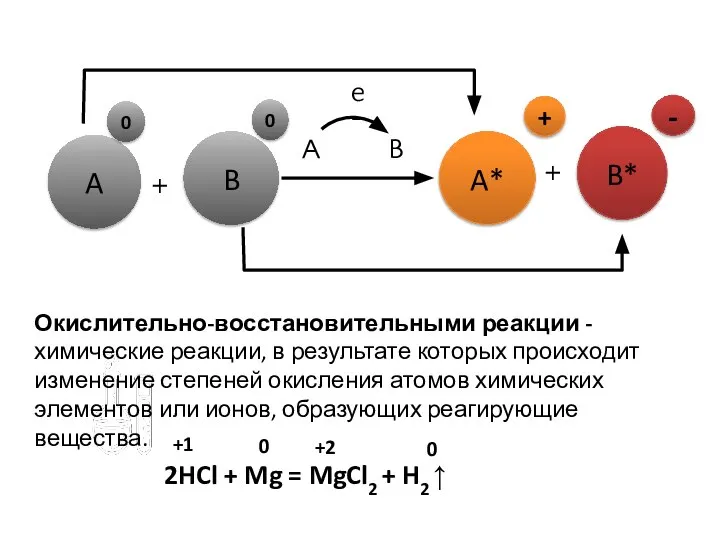
- 7. A B A* B* + + A 0 0 B e– + - Окислительно-восстановительными реакции -
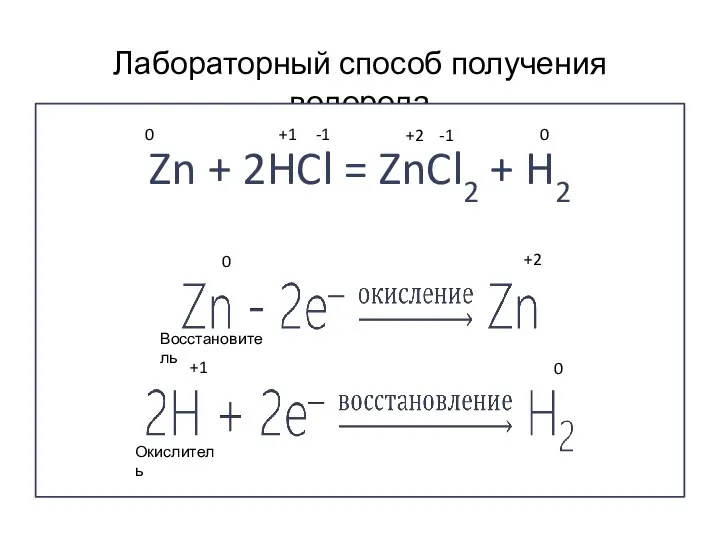
- 8. Лабораторный способ получения водорода Zn + 2HCl = ZnCl2 + H2 +1 0 -1 -1 0
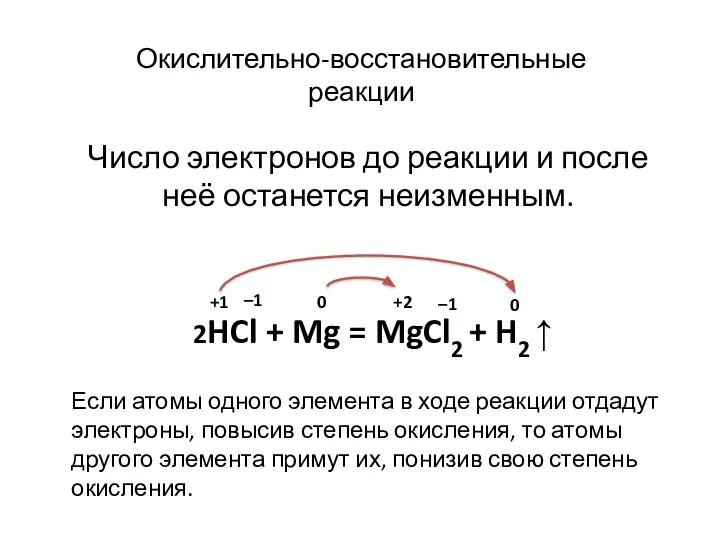
- 9. Число электронов до реакции и после неё останется неизменным. 2HCl + Mg = MgCl2 + H2
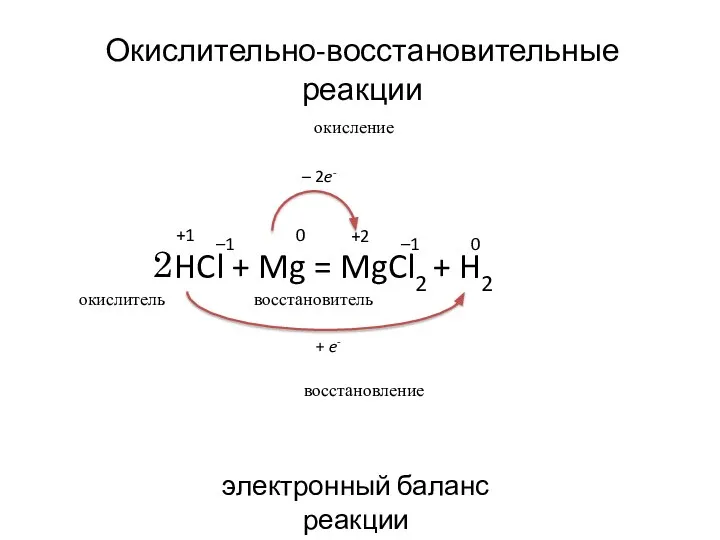
- 10. HCl + Mg = MgCl2 + H2 +1 –1 0 +2 –1 0 окислитель восстановитель окисление
- 12. Скачать презентацию



 Нуклеиновые кислоты: структура и функции
Нуклеиновые кислоты: структура и функции Методы термического обезвреживания промышленных газов
Методы термического обезвреживания промышленных газов Щелочные металлы
Щелочные металлы Химическая техника. Экстракция
Химическая техника. Экстракция Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Каучук и резина
Каучук и резина Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Тема урока Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел.
Тема урока Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. НАШ НЕБЕЗПЕЧНИЙ ПОБУТ Презентація на тему того,про що ми не думаємо у повсякденному житті.
НАШ НЕБЕЗПЕЧНИЙ ПОБУТ Презентація на тему того,про що ми не думаємо у повсякденному житті.  Основные понятия и законы химии
Основные понятия и законы химии Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Кислоты и классы химических веществ. 8 класс
Кислоты и классы химических веществ. 8 класс Нитраты. Ход исследовательской работы
Нитраты. Ход исследовательской работы Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Органічні сполуки і здоров'я людини
Органічні сполуки і здоров'я людини Структура нуклеїнових кислот
Структура нуклеїнових кислот Cоляная кислота и ее соли
Cоляная кислота и ее соли Презентация по Химии "Химические вещества в архитектуре города Минусинска" - скачать смотреть
Презентация по Химии "Химические вещества в архитектуре города Минусинска" - скачать смотреть  Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae
Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae Классификация и ассортимент клея
Классификация и ассортимент клея Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Химические индикаторы
Химические индикаторы Камни и Водолей
Камни и Водолей Биологическая роль и строение нуклеиновых кислот
Биологическая роль и строение нуклеиновых кислот Генетика клеточного цикла. Протеолиз циклина под контролем АРС. (Глава 4)
Генетика клеточного цикла. Протеолиз циклина под контролем АРС. (Глава 4) Решение задач по теме «Растворы»
Решение задач по теме «Растворы» Магматические горные породы
Магматические горные породы