Содержание
- 2. Важно! № группы = количеству электронов на внешнем уровне № периода = количеству электронных уровней от
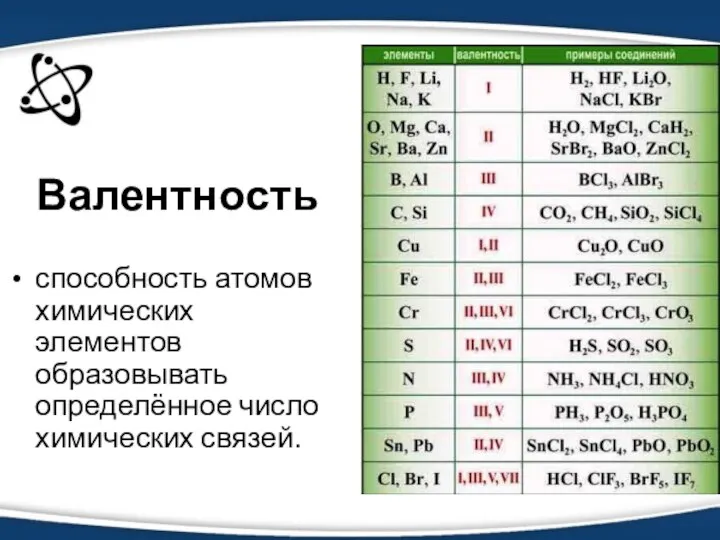
- 3. Валентность способность атомов химических элементов образовывать определённое число химических связей.
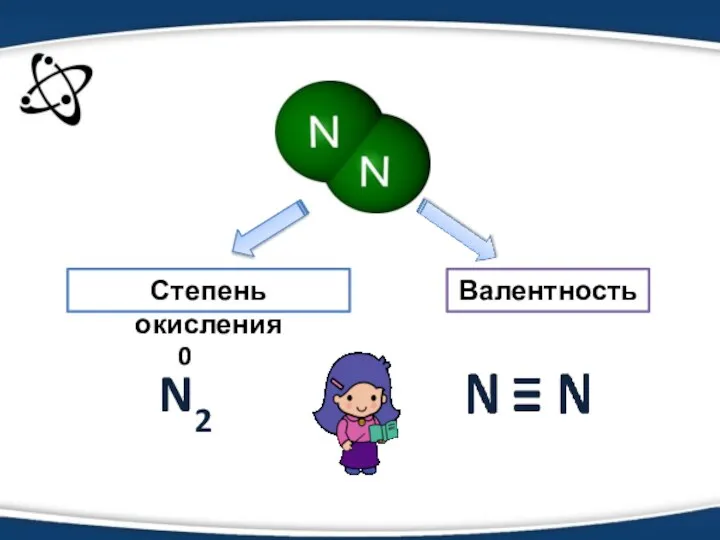
- 4. Степень окисления Валентность
- 5. Электроотрицательность это способность атомов притягивать электроны при связывании с другими атомами. Окислитель – забирает электроны («окислитель–
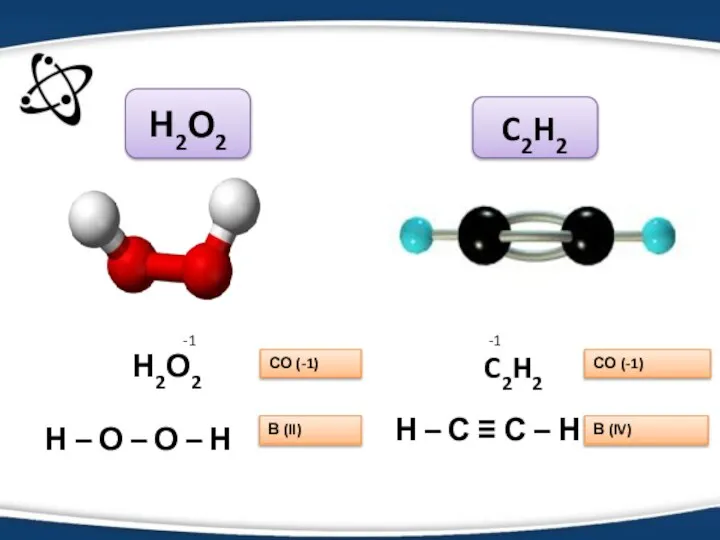
- 6. Н2О2 Н – О – О – Н СО (-1) В (II) C2H2 СО (-1) Н
- 7. Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит
- 8. Минимальная степень окисления = № группы – 8, у N (-3) Максимальная степень окисления равна номеру
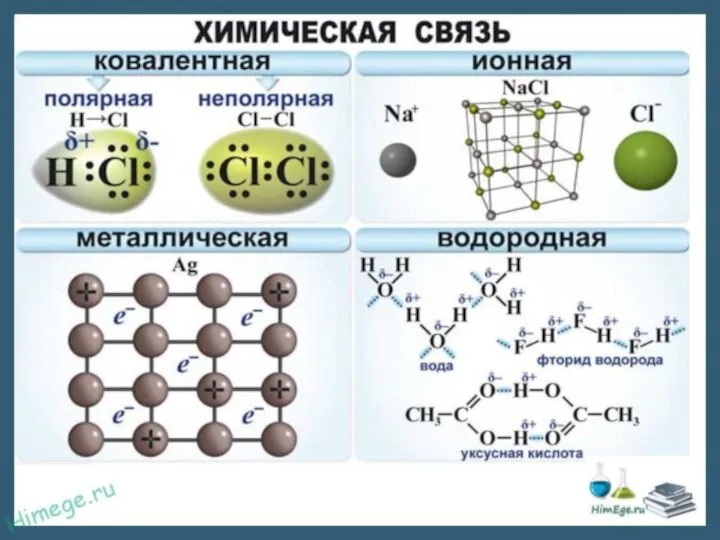
- 9. Образуется между ионами – заряженными частицами; Образуется между элементами, Электроотрицательность которых сильно отличается друг от друга;
- 10. Ковалентная неполярная связь Образуется между элементами неметаллами с одинаковой Электроотрицательность за счет объединения неспаренных электронных пар
- 11. Ковалентная полярная связь Образуется между элементами неметаллами, Электроотрицательность которых незначительно отличается друг о друга. Между неметаллами
- 12. Образуется между атомами и ионами металлов. Существует в простых веществах металлах, а также в их сплавах.
- 13. Образуется между водородом и более электроотрицательным элементом. Чаще всего это кислород, азот, сера. Связь непрочная, но
- 16. Скачать презентацию









 Особенности соединений углерода, их многообразие, роль в живой природе и практической деятельности человека
Особенности соединений углерода, их многообразие, роль в живой природе и практической деятельности человека Таблица Периодическая система Д.И.Менделеева
Таблица Периодическая система Д.И.Менделеева Углеводы. Глюкоза. ЗНАНИЯ, НЕПРОВЕРЕННЫЕ ОПЫТОМ, МАТЕРЬЮ ВСЯКОЙ ДОСТОВЕРНОСТИ, БЕСПЛОДНЫ И ПОЛНЫ ОШИБОК ЛЕОНАРДО ДА ВИНЧИ
Углеводы. Глюкоза. ЗНАНИЯ, НЕПРОВЕРЕННЫЕ ОПЫТОМ, МАТЕРЬЮ ВСЯКОЙ ДОСТОВЕРНОСТИ, БЕСПЛОДНЫ И ПОЛНЫ ОШИБОК ЛЕОНАРДО ДА ВИНЧИ 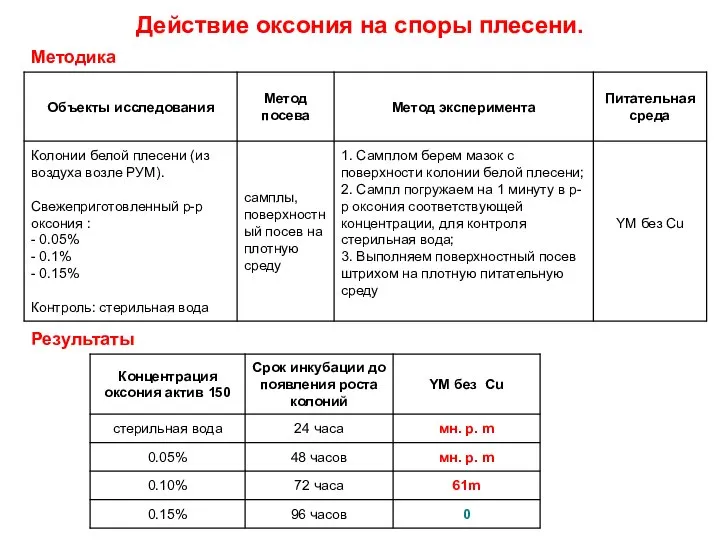 Действие оксония на споры плесени
Действие оксония на споры плесени Средства для борьбы с насекомыми
Средства для борьбы с насекомыми Соли. Тема 3
Соли. Тема 3 Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Альдегиды. (10 класс)
Альдегиды. (10 класс) Классификация терпенов
Классификация терпенов Общая химия
Общая химия Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_
Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_ Определение концентрации хлорид – ионов в питьевой воде
Определение концентрации хлорид – ионов в питьевой воде Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Альдегиды и кетоны
Альдегиды и кетоны Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Концентрированная серная кислота Учитель: Немухина Н.Р. МБОУ СОШ № 1 г. Королева
Концентрированная серная кислота Учитель: Немухина Н.Р. МБОУ СОШ № 1 г. Королева  Экстракция
Экстракция Привычная и удивительная поваренная соль
Привычная и удивительная поваренная соль Buxarlanma ve kondensasiya
Buxarlanma ve kondensasiya d-Элементы I Б группы
d-Элементы I Б группы  Пищевые добавки
Пищевые добавки Предмет химии. Основные задачи курса
Предмет химии. Основные задачи курса Титан как элемент
Титан как элемент Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Основные сырьевые материалы для производства портландцемента
Основные сырьевые материалы для производства портландцемента Теория горения горючих дисперсных материалов
Теория горения горючих дисперсных материалов  Процесс травления тонких линий
Процесс травления тонких линий Кипение. Испарение
Кипение. Испарение