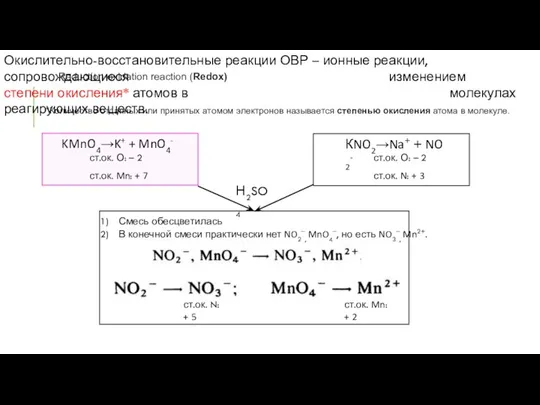
MnO4- + 8Н+ +5е
Mn2+ + 4Н2О
реакция восстановления (принимает электроны),
MnO4‒ -
окислитель Ox
уравниваем число атомов, которые меняют степень окисления;
считаем число атомов О в левой и правой частях;
каждый О – это 2 «–»;
в кислой среде Н+, Н2О→ Н+, Н2О;
уравниваем число «–» по кислооду;
уравниваем число атомов Н при помощи молекул Н2О;
считаем заряды частиц, добавляем нужное кол-во е.
число Mn слева и справа одинаковое;
О слева – 4, справа – 0;
слева – это 8 «–», справа – 0;
в кислой среде Н+, Н2О→ Н+, Н2О;
чтобы уравнять число минусов добавляем в левую часть 8 Н+, потому что не можем добавить «–» справа;
добавляем в правую часть 4 Н2О, чтобы число атомов Н было одинаковым;
слева – 1 «–» и 8 «+» = 7 «+», а справа – 2 «+», разница в 5 «+», добавляем 5 е, потому что 1 е – это 1 «–».
NO2- + Н2O - 2е
NO3- + 2Н+
реакция окисления (отдает электроны),
NO2‒ - восстановитель Red
ЧИСЛО ПРИНЯТЫХ И ОТДАНЫХ ЭЛЕКТРОНОВ ДОЛЖНО БЫТЬ ОДИНАКОВЫМ














 Кейс № 4.1 одежда для металла
Кейс № 4.1 одежда для металла Презентация по Химии "Этот многоликий Кальцит" - скачать смотреть
Презентация по Химии "Этот многоликий Кальцит" - скачать смотреть  Хлористый водород
Хлористый водород Предельные углеводороды. Алканы и циклоалканы. Лекция № 2
Предельные углеводороды. Алканы и циклоалканы. Лекция № 2 Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Химические свойства кислот с позиции теории электролитической диссоциации
Химические свойства кислот с позиции теории электролитической диссоциации Химическая связь 11 класс
Химическая связь 11 класс  6 классов ферментов и тривиальные названия некоторых основных групп
6 классов ферментов и тривиальные названия некоторых основных групп Электродные потенциалы. Окислительно-восстановительные потенциалы. Потенциометрия в медицинской практике
Электродные потенциалы. Окислительно-восстановительные потенциалы. Потенциометрия в медицинской практике Характеристика азота как химического элемента и простого вещества. Урок химии в 9 классе.
Характеристика азота как химического элемента и простого вещества. Урок химии в 9 классе. Тепловой эффект сгорания топлива
Тепловой эффект сгорания топлива КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ 9 класс МКОУ «СОШ № 85» г. Тайшет Иркутской обл. Учитель: Никитюк Л.Ф.
КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ 9 класс МКОУ «СОШ № 85» г. Тайшет Иркутской обл. Учитель: Никитюк Л.Ф. Химические волокна
Химические волокна Строение атома
Строение атома Бинарный интегрированный урок (география + химия) . 8 класс
Бинарный интегрированный урок (география + химия) . 8 класс Компоненты нефти, газов и нефтепродуктов. Состав, строение, свойства. Насыщенные углеводороды
Компоненты нефти, газов и нефтепродуктов. Состав, строение, свойства. Насыщенные углеводороды Диаграммы Пурбе
Диаграммы Пурбе Лимонная кислота
Лимонная кислота Металлические сплавы
Металлические сплавы Массообменные процессы
Массообменные процессы Вещества и материалы. Классификация веществ. Индикаторы. 6 класс
Вещества и материалы. Классификация веществ. Индикаторы. 6 класс Осадочные породы. (Лекция 9.2)
Осадочные породы. (Лекция 9.2) Нуклеиновые кислоты
Нуклеиновые кислоты Поделочные или полудрагоценные камни
Поделочные или полудрагоценные камни Определение содержания солей в нефти
Определение содержания солей в нефти Галогены. Галогеноводороды
Галогены. Галогеноводороды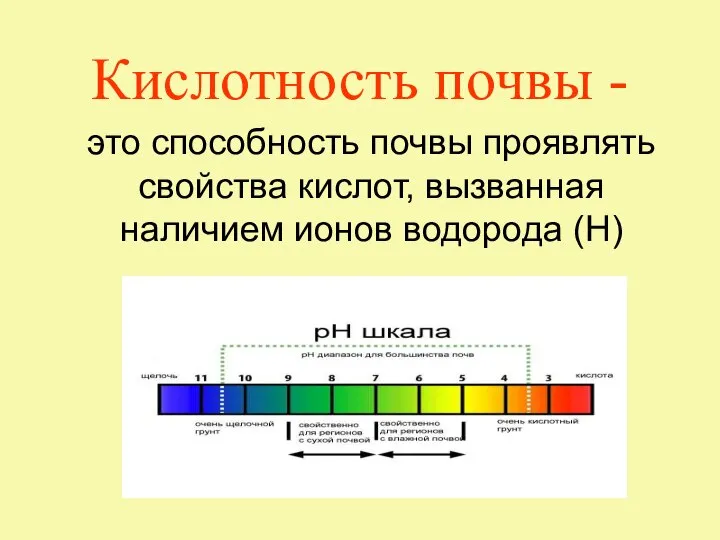 Кислотность почвы
Кислотность почвы Масса молекул. Количество вещества
Масса молекул. Количество вещества