Содержание
- 2. Кислородные соединения галогенов Cl2O ClO2 ClO3(Cl2O6) Cl2O7 Желто-оранж. газ Желтый газ Темно-красная жидкость IV VI I
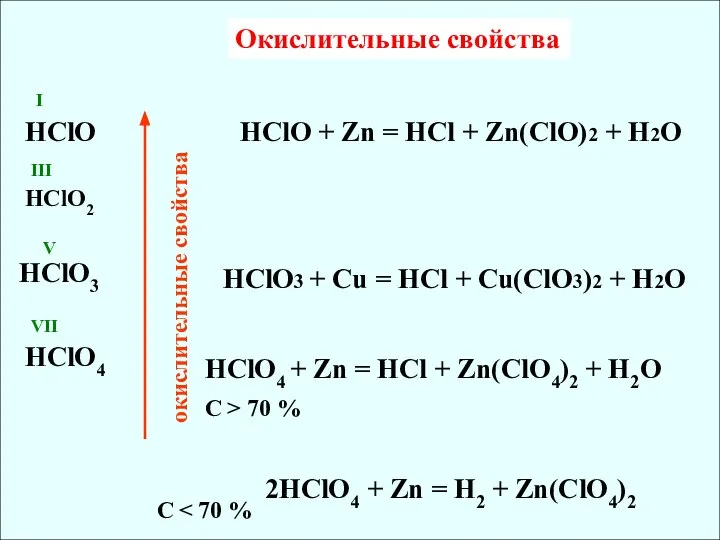
- 3. окислительные свойства Окислительные свойства VII V III I HClO HClO2 HClO3 HClO4 HClO + Zn =
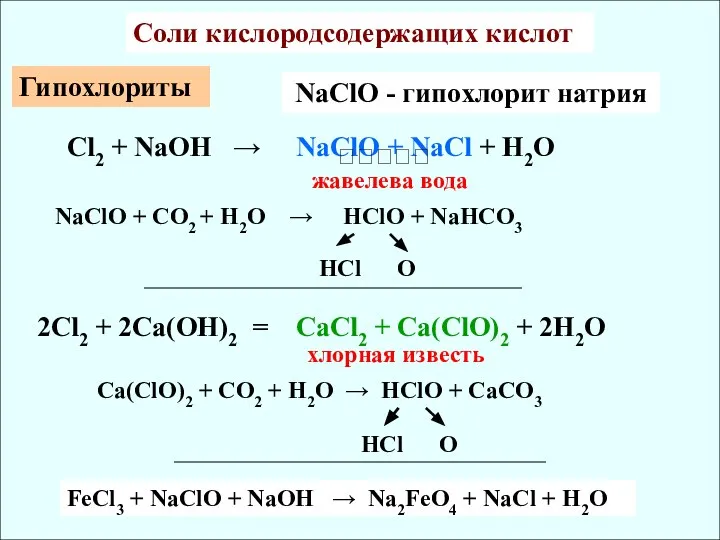
- 4. Cоли кислородсодержащих кислот Гипохлориты NaClO + CO2 + H2O → HClO + NaHCO3 HCl O NaClO
- 5. Хлораты KClO3 - бертолетова соль KClO3 → KClO4 + KCl (t = 400°C) KClO3 + C12H22O11
- 6. HBrO3 HIO3 Кислородсодержащие кислоты брома и йода Бромноватая кислота - броматы Йодноватая кислота - йодаты KIO3
- 7. Кислородные соединения халькогенов +IV SO2 SeO2 TeO2 Бесцв. газ Бел., тв. Бел., тв. H2SO3 H2SeO3 H2TeO3
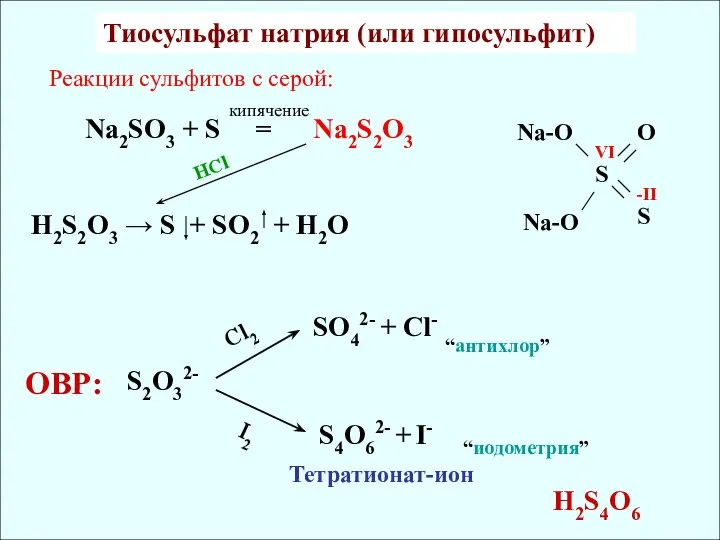
- 8. Реакции сульфитов с серой: Na2SO3 + S = Na2S2O3 H2S2O3 → S + SO2 + H2O
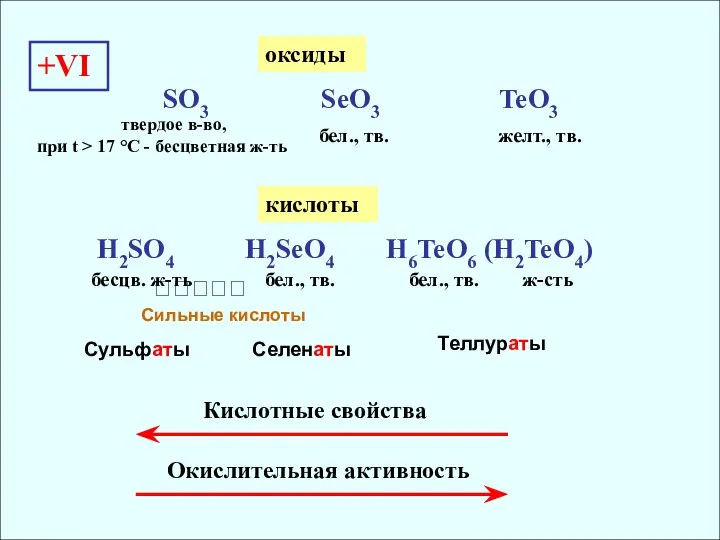
- 9. +VI SO3 SeO3 TeO3 бел., тв. желт., тв. Кислотные свойства H2SO4 H2SeO4 H6TeO6 (H2TeO4) бесцв. ж-ть
- 10. H2SO4 98,3 % р-р H2SO4: ρ = 1,84 г/см3, t.кип. 338 °С, SO3 + H2O =
- 11. Соли – сульфаты и гидросульфаты. BaSO4, SrSO4, PbSO4 видио №11 CuSO4 · 5H2O FeSO4 · 7H2O
- 12. H2SO4·nSO3 - олеум Пиросерная (двусерная) кислота и ее соли (H2SO4 · SO3 ) 2KHSO4 K2S2O7 +
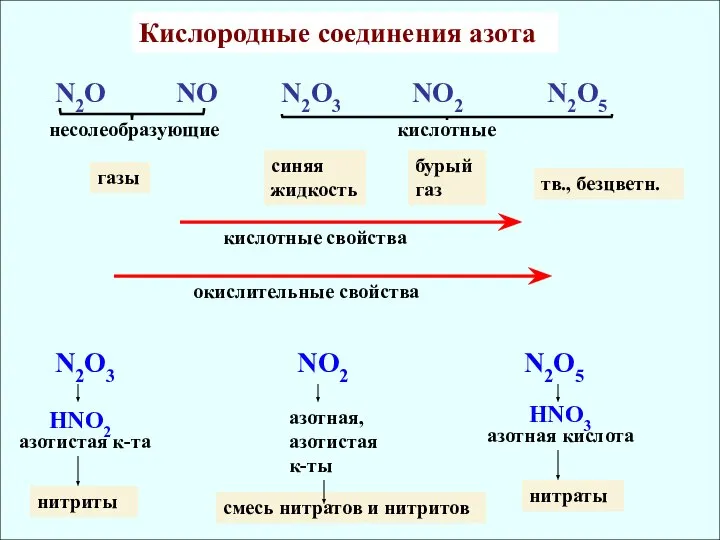
- 13. Кислородные соединения азота N2O NO N2O3 NO2 N2O5 несолеобразующие кислотные кислотные свойства газы тв., безцветн. окислительные
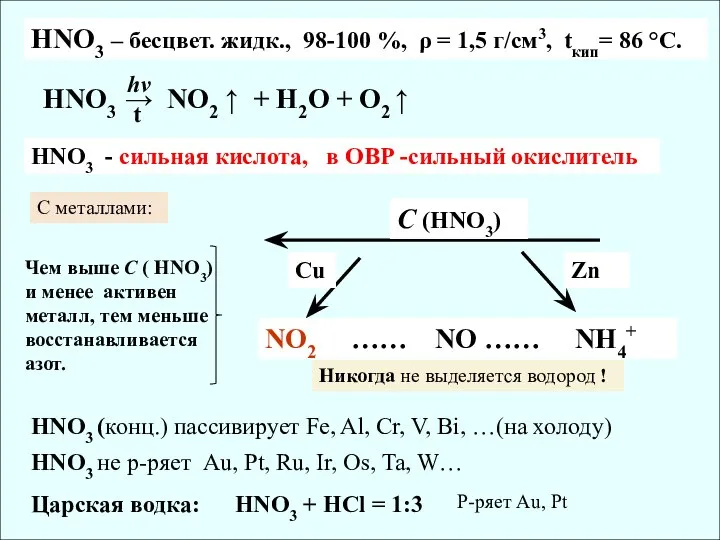
- 14. HNO3 → NO2 ↑ + H2O + O2 ↑ hν HNO3 – бесцвет. жидк., 98-100 %,
- 15. Au + HNO3 + HCl → H[AuCl4] + NO + H2O HNO3 + S → H2SO4
- 16. N2O3 + H2O → HNO2 нестойкая, слабая к-та, сущ-ет в водном р-ре при низких тем-рах Разлагается:
- 18. Скачать презентацию







![Au + HNO3 + HCl → H[AuCl4] + NO + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194377/slide-14.jpg)

 Презентация по Химии "Ярмарок професій" - скачать смотреть
Презентация по Химии "Ярмарок професій" - скачать смотреть  Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т
Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т Тесты для самопроверки
Тесты для самопроверки Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Растворы. Первичные понятия
Растворы. Первичные понятия Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64
Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64 Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice
Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна
Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна  Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В.
Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В. Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Отдельные классы дисперсных систем
Отдельные классы дисперсных систем Воздушные и тепловые свойства почв
Воздушные и тепловые свойства почв Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Своя игра по химии
Своя игра по химии Алкены
Алкены Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Открытие периодического закона Д.И. Менделеева
Открытие периодического закона Д.И. Менделеева Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина
Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности
Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности Коррозия металлов
Коррозия металлов Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Особенности строения, реакционной способности и методы синтеза аренов
Особенности строения, реакционной способности и методы синтеза аренов Презентация по Химии "Классификация углеводородов" - скачать смотреть
Презентация по Химии "Классификация углеводородов" - скачать смотреть  Силикаты. Пироксены. Амфиболы. Полевые шпаты
Силикаты. Пироксены. Амфиболы. Полевые шпаты Мыс айналымы
Мыс айналымы Хроматографический анализ
Хроматографический анализ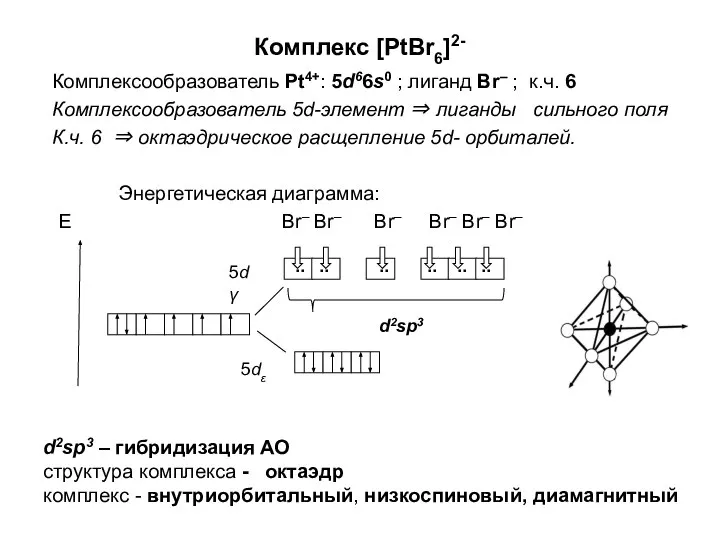 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)