Содержание
- 2. Физические свойства В обычных условиях летучая бесцветная жидкость (tкип = 43°С) с удушливым запахом. При температуре
- 3. Получение оксида серы (VI) 1. Окисление кислородом воздуха SO2 при нагревании в присутствии катализатора 2SO2 +
- 4. Характеристика реакции окисления оксида серы (IV) 1. Реакция окислительно-восстановительная. 2. Реакция соединения, т.к. из двух соединений
- 5. Химические свойства оксида серы (VI) Опишите химические свойства оксида серы (VI) как типичного кислотного оксида, приведя
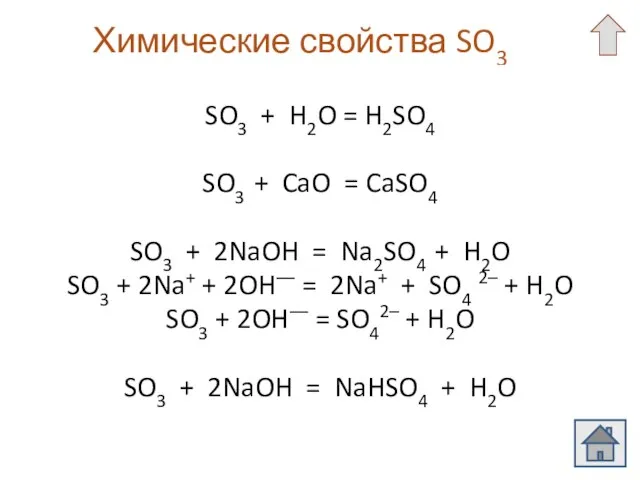
- 6. Химические свойства SO3 SO3 + H2O = H2SO4 SO3 + CaO = CaSO4 SO3 + 2NaOH
- 8. Скачать презентацию




 Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно
Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно Нуклеиновые кислоты
Нуклеиновые кислоты Химический состав молока
Химический состав молока Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов Способы перегонки
Способы перегонки Сера. Свойства серы
Сера. Свойства серы Цирконий. Схема получения чистого циркония
Цирконий. Схема получения чистого циркония Виконали: Алексеенко О.В. Перегонцева А.А.
Виконали: Алексеенко О.В. Перегонцева А.А.  Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Возведение наземных стальных резервуаров
Возведение наземных стальных резервуаров Хроматография. (Лекция 4)
Хроматография. (Лекция 4) Соединения алюминия
Соединения алюминия Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей Химия неметаллов
Химия неметаллов Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Химические источники тока
Химические источники тока “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Соль – основа жизни
Соль – основа жизни Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер
Аэрозольдер, ұнтақтар, суспензиялар, эмульсиялар, көбіктер Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Методика изучения современной теории строения органических веществ
Методика изучения современной теории строения органических веществ Химическая физика горения
Химическая физика горения Химия вопросы и ответы
Химия вопросы и ответы Презентация по Химии "Алюминий и его соединения" - скачать смотреть
Презентация по Химии "Алюминий и его соединения" - скачать смотреть  Степень окисления
Степень окисления Презентация Каучук Органическая химия 10 класс
Презентация Каучук Органическая химия 10 класс Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды