Содержание
- 2. Программа курса Вводная лекция. История изучения процессов горения и современное состояние исследований. Термодинамика процессов горения, температура
- 3. Программа курса Численное моделирование многокомпонентных реагирующих газовых потоков с применением многостадийных механизмов реакций и детальной кинетики
- 5. Горение – это сложный физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением тепла, ярким свечением
- 6. ИСТОРИЯ РАЗВИТИЯ ЗНАНИЙ О ГОРЕНИИ люди начали пользоваться огнем для обогрева и приготовления пищи 600 тысяч
- 7. Порох – Китай, Япония - IX век
- 8. Огню отводилось значительное место в ранних мифах и легендах, например, в греческом мифе о Прометее, похитившем
- 9. Огонь — наиболее динамичная, изменчивая из всех стихий, первоначало мира, в то время как вода —
- 10. Одна из первых теорий, объясняющих сущность процесса горения - теория флогистона. Иоганн Иоахим Бехер, 1703 г
- 11. Роберт Бойль считал, что при нагревании металлов «огненная материя» соединяется с металлами и превращает их в
- 12. Ломоносов М.В. 1711-1765 Антуа́н Лора́н Лавуазье́ 1743-1794 Закон сохранения массы вещества (Ломоносов -1756 г, Лавуазье -
- 13. Майкл Фарадей 1791 - 1867 История свечи (1861)
- 14. Ро́берт Ха́тчингс Го́ддард (1882—1945 ) один из пионеров современной ракетной техники Эра жидкостных ракетных двигателей -
- 15. Разработка в России ракет ГИРД-9 и ГИРД-10, первый запуск 17 августа 1933г Тихонра́вов М.К. 1900-1974 Королев
- 16. Никола́й Никола́евич Семёнов (1896-1986), единственный советский лауреат Нобелевской премии по химии (получил в 1956 году совместно
- 17. Зельдо́вич Я́ков Бори́сович (1914-1987) Установление связи между скоростью распространения пламени и кинетикой химических реакций Условия поджигания
- 18. Основные области применения горения Тепловые электростанции на горении угля, жидкого топлива. Печи для получения стали, цветных
- 19. В настоящее время горение является основным источником энергии. Более 85% потребляемой энергии в мире имеет своим
- 20. .
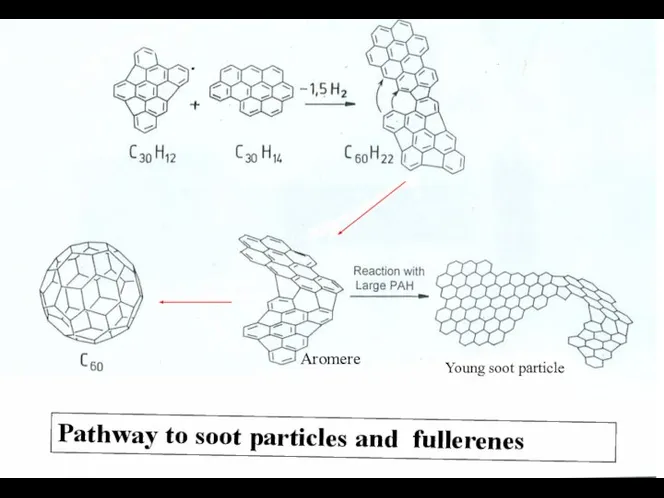
- 21. . Pathway to soot particles and fullerenes Young soot particle Aromere
- 22. .
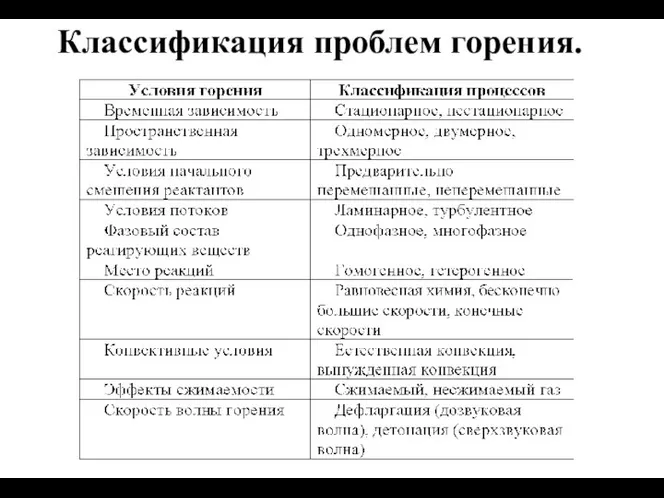
- 23. Классификация проблем горения.
- 24. Процедуры разработки теоретической модели 1. Укажи общие цели модели 2. Разработай физическую модель, основанную на понимании
- 25. Основные соотношения в теории горения Сохранение масс. Химическую реакцию можно записать как где Мi – химический
- 26. Массовый баланс для одностадийной реакции . где Wi – молекулярный вес i-й компоненты смеси. Определение долей
- 27. индекс st соответствует стехиометрической реакции, например: CH4 + 2O2 → CO2 + 2H2O. Для бедных топливом
- 28. СТАНДАРТНЫЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ ВЕЩЕСТВ Вещество ΔНf0 ккал/моль Атом кислорода О (г) 59,5 Окись азота NО (г)
- 29. Теплота реакции Рассмотрим реакцию Теплота реакции при стандартных условиях при температуре Т0: Во многих случаях требуется
- 30. . Используя (х), (хх), а также приняв р = 1 атм., Т1 = Т0 = 298,16
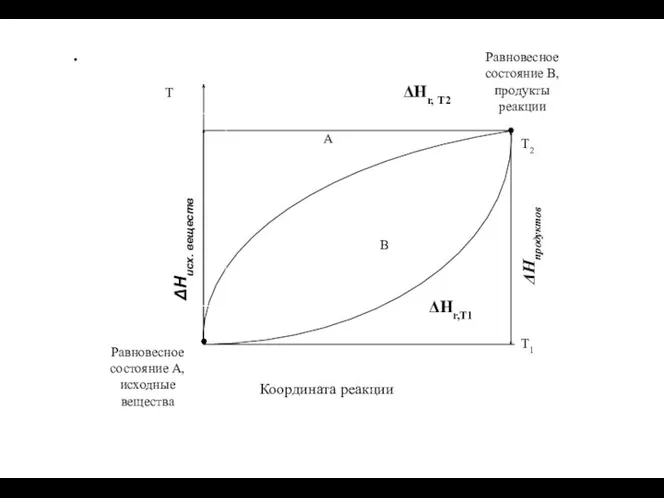
- 31. . А В Равновесное состояние А, исходные вещества Координата реакции Равновесное состояние В, продукты реакции ΔHr,T1
- 33. Пример 1. Найти теплоту реакции окисления этана С2Н6. С2Н6 + 3,5O2 → 2CO2 + 3H2O. ΔН
- 34. Решение. Уравнения сохранения элементов: С: O: 15(0,21∙2) = N: 15(0,79∙2) = H: Решая эти уравнения, получим
- 37. УЧЕТ ДИССОЦИАЦИИ ПРОДУКТОВ РЕАКЦИИ Приведенный выше метод вычисления приемлем только, если Тf
- 38. Химический состав системы в равновесии Рассмотрим обратимую реакцию: При условии, что все компоненты находятся в газообразном
- 39. По определению, свободная энергия Гиббса: G ≡ H - TS В химических процессах одновременно действуют два
- 40. Существует соотношение, связывающее изменение свободной энергии Гиббса в ходе химической реакции с её константой равновесия: или
- 41. Пример 3. Рассмотрим реакцию окисления метана при недостатке кислорода CH4+1.5O2=CO+2H2O, которая благодаря реакции водяного газа СО
- 42. (А)
- 43. Для химической реакции в адиабатической системе CH4+1.5O2=(1-η)CO+(2- η)H2O+ η CO2+ η H2 Можно записать уравнение сохранения
- 44. Это выражение можно переписать для индивидуальных соединений: (Б)
- 46. Скачать презентацию








































 Сущность процесса электролиза
Сущность процесса электролиза Твердость минералов и их применение
Твердость минералов и их применение Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства
Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства Биодеградируемые полимеры – продукты биотехнологии
Биодеградируемые полимеры – продукты биотехнологии Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Гетероциклические соединения
Гетероциклические соединения Минеральный состав пород
Минеральный состав пород Нарушение метаболизма
Нарушение метаболизма Миграция химических элементов
Миграция химических элементов Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Алкадиены Непредельные углеводороды
Алкадиены Непредельные углеводороды Біохімія білків
Біохімія білків Жидкие кристаллы
Жидкие кристаллы Токсические химические элементы. Химизм действия
Токсические химические элементы. Химизм действия Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии
Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии Корунд. Разновидности корунда
Корунд. Разновидности корунда Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно
Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Предмет химии. Основные задачи курса
Предмет химии. Основные задачи курса Презентация по теме: Химический состав клетки
Презентация по теме: Химический состав клетки Основы химической термодинамики
Основы химической термодинамики ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА» Легированные конструкционные стали. Инструментальные легированные стали
Легированные конструкционные стали. Инструментальные легированные стали Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae
Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)