Содержание
- 2. Выполните превращение CuS—H2S—SO2—SO3 Рассчитайте степени окисления серы в соединениях. Назовите вещества.
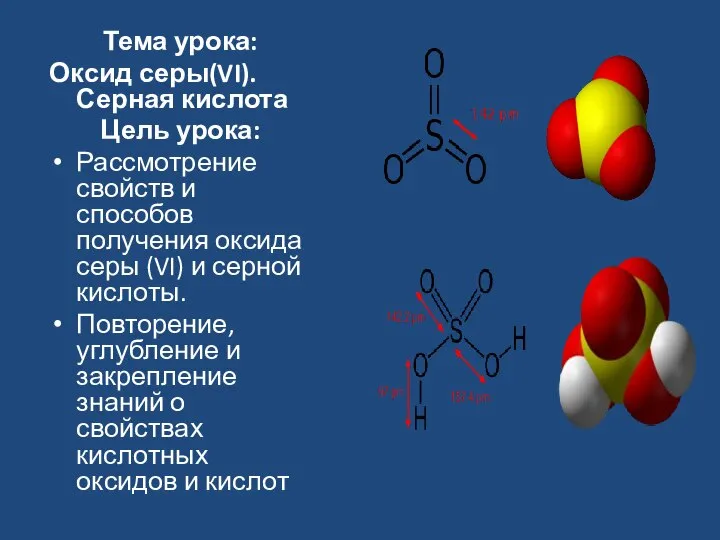
- 3. Тема урока: Оксид серы(VI). Серная кислота Цель урока: Рассмотрение свойств и способов получения оксида серы (VI)
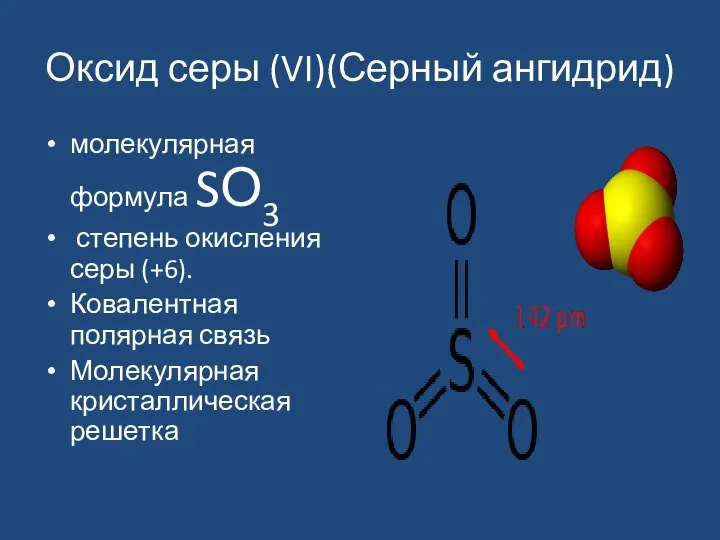
- 4. Оксид серы (VI)(Серный ангидрид) молекулярная формула SО3 степень окисления серы (+6). Ковалентная полярная связь Молекулярная кристаллическая
- 5. Оксид серы (VI) SО3 - ангидрид серной кислоты бесцветная жидкость при комнатной температуре, затвердевающая уже при
- 6. Химические свойства кислотных оксидов ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид +Вода= Кислота (р. соединения) СO2
- 7. Напишите уравнения реакций: оксида серы (VI)+ вода, оксида серы (VI) +щелочь, оксида серы (VI) + основной
- 8. Химические свойства оксида серы (VI) Серный ангидрид - кислотный оксид. 1)При растворении в воде дает сильную
- 9. СЕРНАЯ КИСЛОТА - H2SO4 Тяжелая маслянистая жидкость ("купоросное масло"); r = 1,84 г/см3; нелетучая, хорошо растворима
- 10. Кислоту вливать малыми порциями в воду, а не наоборот! Помните!
- 12. Химические свойства кислот 1. Изменяют окраску индикатора. 2.Реагируют с металлами в ряду активности до H2 (искл.
- 13. Напишите уравнения реакций: Серная кислота + магний Серная кислота + оксид цинка Серная кислота + гидроксид
- 14. Химические свойства разбавленной серной кислоты H2SO4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус
- 15. 3) Взаимодействие с основными и амфотерными оксидами: ZnO + H2SO4 → ZnSO4 + H2O ZnO +
- 16. Качественная реакция на сульфат-ион: Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты
- 17. Окислительные свойства Концентрированной серной кислоты
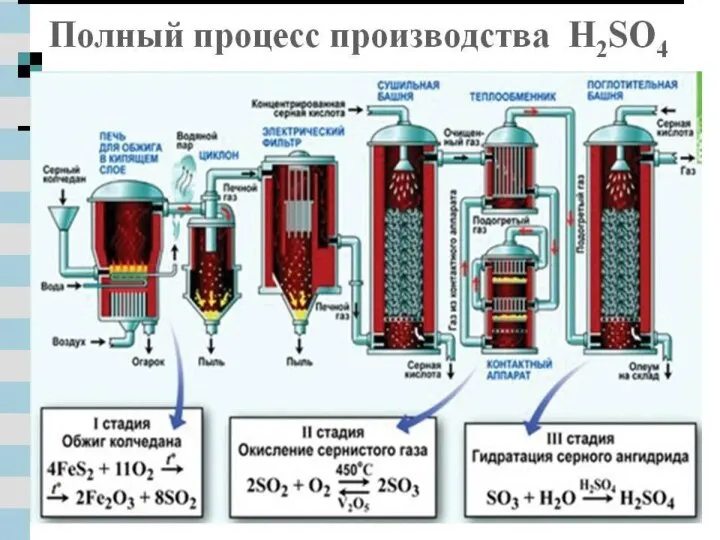
- 18. Значение серной кислоты. Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей,
- 19. Соли серной кислоты. Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в
- 20. Токсическое действие Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные
- 21. Охрана окружающей среды. Охране окружающей среды в нашей стране уделяется большое внимание. На сернокислотных заводах предотвратить
- 22. Осуществите превращения по схеме: S—SO2—SO3—H2SO4-- Na2SO4 Zn – ZnSO4– Zn(OH) 2—ZnSO4—BaSO4
- 24. Скачать презентацию


















 Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Хром. Нахождение хрома в природе
Хром. Нахождение хрома в природе Связь между основными классами неорганических соединений
Связь между основными классами неорганических соединений Строение электронных оболочек атомов
Строение электронных оболочек атомов Липиды. Классификация липидов
Липиды. Классификация липидов Теоретические основы технологии неорганических веществ. (Тема 2)
Теоретические основы технологии неорганических веществ. (Тема 2) Реакции средних солей
Реакции средних солей Дифракционные методы исследований наноматериалов
Дифракционные методы исследований наноматериалов Биохимическая классификация гормонов
Биохимическая классификация гормонов Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Нефть — это жидкое горючее полезное ископаемое
Нефть — это жидкое горючее полезное ископаемое Синтез олигомеров этиленгликоля и терефталевой кислоты
Синтез олигомеров этиленгликоля и терефталевой кислоты Топаз
Топаз Одноатомні спирти Підготували Учениці 9-Б класу
Одноатомні спирти Підготували Учениці 9-Б класу  Электросинтез. (Тема 7)
Электросинтез. (Тема 7) Биологическое окисление 2. Оксигеназные, пероксидазные и радикальные пути использования кислорода. (Лекция 5)
Биологическое окисление 2. Оксигеназные, пероксидазные и радикальные пути использования кислорода. (Лекция 5) Green chemistry application to intermolecular forces
Green chemistry application to intermolecular forces Химия и здоровье человека
Химия и здоровье человека Метаморфические горные породы
Метаморфические горные породы Карбон кыш
Карбон кыш Растворы Электролитическая диссоциация
Растворы Электролитическая диссоциация Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация по Химии "Химическая связь и строение атома" - скачать смотреть бесплатно
Презентация по Химии "Химическая связь и строение атома" - скачать смотреть бесплатно Фосфор и его соединения
Фосфор и его соединения Презентация Качество продукции
Презентация Качество продукции  Презентация Валентность и степень окисления 8 класс
Презентация Валентность и степень окисления 8 класс Щелочноземельные металлы
Щелочноземельные металлы Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги
Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги