Содержание
- 2. Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2,
- 3. Способы получения оксидов. Взаимодействие простых веществ с кислородом: 2Mg + O2 = 2Mg O 2. Горение
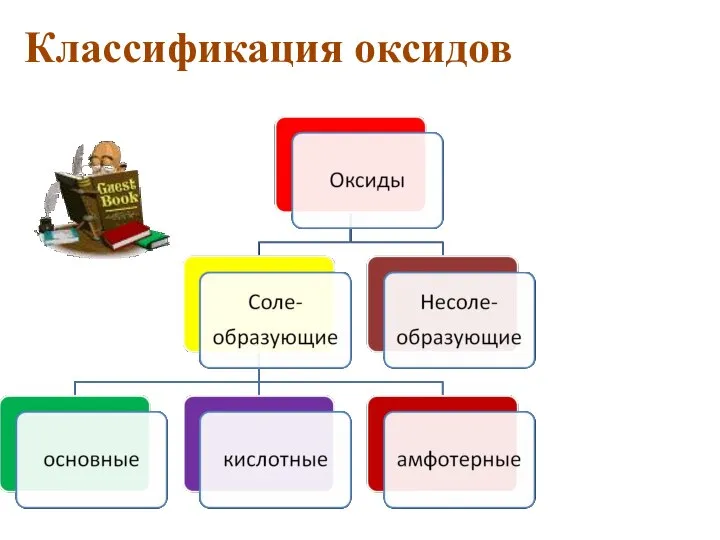
- 4. Классификация оксидов
- 5. Несолеобразующие оксиды Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют
- 6. Основные оксиды Это оксиды, которым в качестве гидроксидов соответствуют основания. Например: CuO → Cu(OH)2 Основные оксиды
- 7. Химические свойства основных оксидов. Взаимодействие с кислотами, с образованием соли и воды: MgO + HCl =
- 8. Кислотные оксиды Это оксиды, которым в качестве гидроксидов соответствуют кислоты. Например: SO3 → H2SO4 Кислотные оксиды
- 9. Химические свойства кислотных оксидов. С основаниями, образуя соль и воду: CO2 + 2KOH = K2CO3 +
- 10. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот. Например: BeO
- 11. Химические свойства амфотерных оксидов. В качестве основных оксидов. С кислотами, образуя соль и воду: ZnO +
- 12. www.brainybetty.com
- 13. Вывод. С повышением степени окисления атомов элемента, образующего оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
- 15. Скачать презентацию











 Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Лаборатория в домашних условиях. Мастер-класс
Лаборатория в домашних условиях. Мастер-класс Магматичні родовища
Магматичні родовища Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Роль витаминов в обмене веществ
Роль витаминов в обмене веществ Химиялық пәндер. Алкалоидтар
Химиялық пәндер. Алкалоидтар СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ
СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ  Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Презентация Электролиты
Презентация Электролиты Менделеевский период
Менделеевский период Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Кількість речовини в хімії
Кількість речовини в хімії  Гігієна води. Лекція 6
Гігієна води. Лекція 6 Природные соединения кремния
Природные соединения кремния Очищение грязной воды
Очищение грязной воды Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Производство шампуня. Технология
Производство шампуня. Технология Роль побутової хімії у житті
Роль побутової хімії у житті Строение вещества. Химические элементы
Строение вещества. Химические элементы ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.
ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.  Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть
Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть  Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда ХІМІЯ В КОСМЕТИЦІ
ХІМІЯ В КОСМЕТИЦІ  Уксусная кислота
Уксусная кислота Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Спирты. Классификация спиртов
Спирты. Классификация спиртов Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Электрохимические производства
Электрохимические производства