Оксигеновмісні сполуки Підготувала учениця 11-Б класу Нововолинського ліцею-інтернату Волинської обласної ради Федина Вале
Содержание
- 2. 1. Спирти: А)Одноатомні спирти ; Б)Багатоатомні спирти: Фенол; Альдегіди; 2. Насичені одноосновні карбонові кислоти; 3. Естери
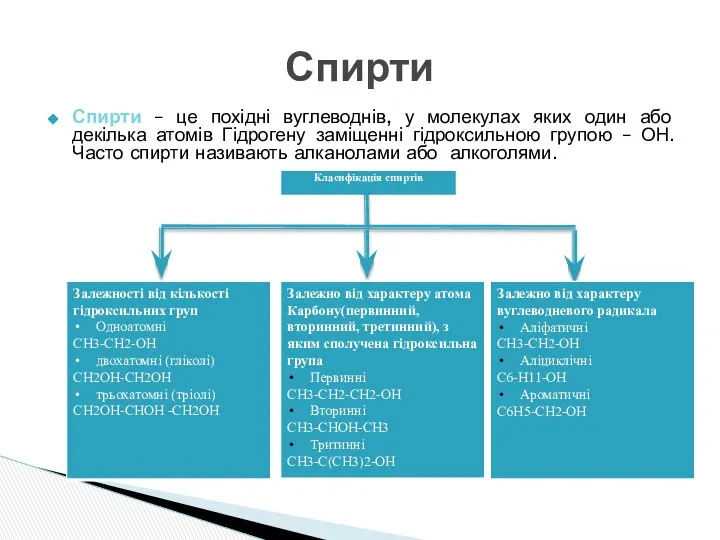
- 3. Спирти – це похідні вуглеводнів, у молекулах яких один або декілька атомів Гідрогену заміщенні гідроксильною групою
- 4. Загальна формула насичених одноатомних спиртів: R-OH, де R — вуглеводневий радикал, або CnH2n+1OH Метанол і етанол
- 5. Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту,
- 6. Представники гомологічного ряду насичених одноатомних спиртів
- 7. Етанол застосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його
- 8. Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи. Двохатомні спирти
- 9. Гліцерол – густа, солодка на смак рідина без кольору, змішується з водою у будь-яких співвідношеннях ;
- 10. Гліцерин використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до масла, у
- 11. Застосування: Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX століття. Його застосування тісно
- 12. Альдегідами називають органічні речовини, молекули яких містять функціональну групу атомів , сполучену з вуглеводневим радикалом. Загальна
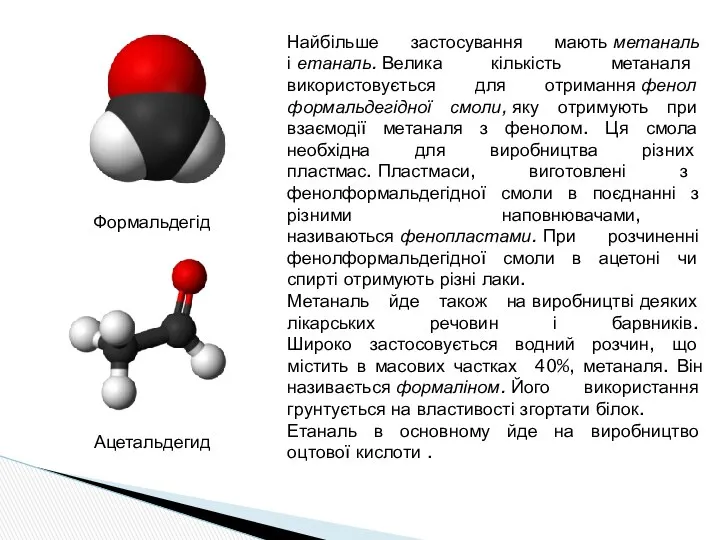
- 13. Найбільше застосування мають метаналь і етаналь. Велика кількість метаналя використовується для отримання фенол формальдегідної смоли, яку
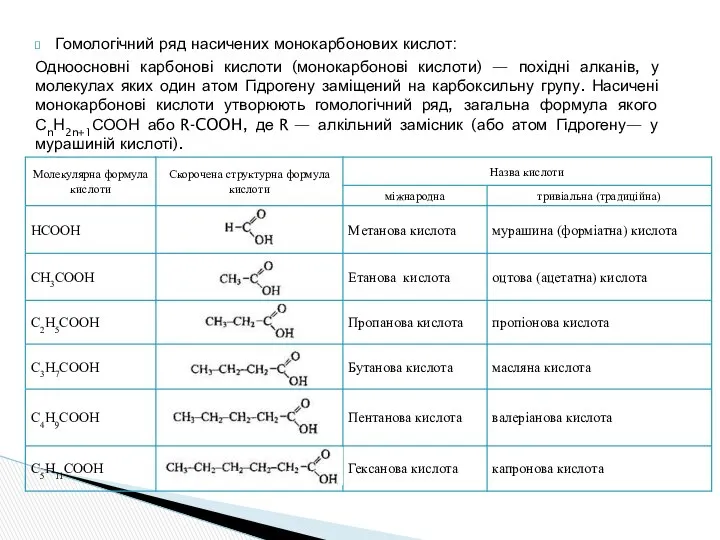
- 14. Карбонові кислоти - це органічні сполуки, до складу яких входять одна або декілька карбоксильних груп –СООН.
- 15. Гомологічний ряд насичених монокарбонових кислот: Одноосновні карбонові кислоти (монокарбонові кислоти) — похідні алканів, у молекулах яких
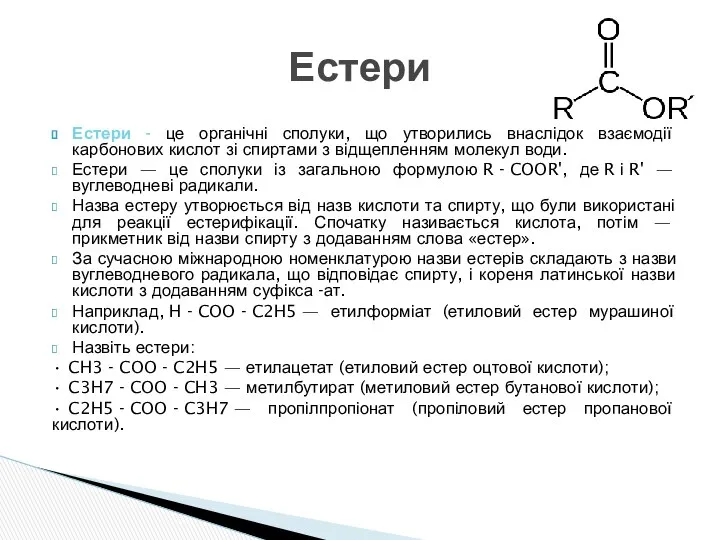
- 16. Естери - це органічні сполуки, що утворились внаслідок взаємодії карбонових кислот зі спиртами з відщепленням молекул
- 17. Естери не розчиняються у воді, добре розчиняються в спирті, етері. Більшість естерів мають приємний запах, унаслідок
- 18. Жири – це повні естери трьохатомного спирту гліцеролу та одноосновних жирних (аліфатичних) кислот. Їх ще називають
- 19. Біологічне значення жирів Біологічне значення жирів зумовлене тим, що вони є носіями таких життєво необхідних для
- 20. Мила - це поверхнево активні речовини (ПАР), які складаються з гідрофобної (вуглеводневий ланцюг) і гідрофільної (група
- 21. Властивості мила (господарське мило 72%) • Якщо змастити господарським милом дрібні подряпини, порізи і ранки, то
- 22. Отож,метою моєї презентації було повторення про одно- та багатоатомні спирти, насичені одноосновні карбонові кислоти, естери, жири
- 24. Скачать презентацию

















 Презентация по Химии "Пилокарпин" - скачать смотреть
Презентация по Химии "Пилокарпин" - скачать смотреть  Все о чае
Все о чае  Химия көшбасшысы
Химия көшбасшысы ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ
ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Сложные эфиры. Жиры
Сложные эфиры. Жиры Полимеры. Использование и вред полиэтилена
Полимеры. Использование и вред полиэтилена Золото
Золото Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Спирты (алканолы)
Спирты (алканолы) α-Аминокислоты. Белки
α-Аминокислоты. Белки Простые вещества. Аллотропия. Классификация простых веществ. Бинарные соединения. Оксиды
Простые вещества. Аллотропия. Классификация простых веществ. Бинарные соединения. Оксиды Химия. Кроссворд
Химия. Кроссворд Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05
Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05 Угольная кислота и ее соли
Угольная кислота и ее соли Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Дослід Ознайомлення зі змістом етикеток харчових продуктів
Дослід Ознайомлення зі змістом етикеток харчових продуктів  Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко
Урок по химии в 10 классе: «Углерод и кремний – р-элементы IVA-группы» подготовил учитель химии и биологии ГУО СШ №163 г.Минска Ко Углеводороды
Углеводороды Протолитические равновесия и процессы
Протолитические равновесия и процессы Роль липидов в формировании потребительских свойств
Роль липидов в формировании потребительских свойств Презентация по Химии "Загальні способи добування металів" - скачать смотреть бесплатно
Презентация по Химии "Загальні способи добування металів" - скачать смотреть бесплатно Пример практического тура. Всероссийская олимпиада школьников по химии
Пример практического тура. Всероссийская олимпиада школьников по химии