Содержание
- 2. Основания Основания – это сложные вещества, молекулы которых состоят из атомов металла (или группы аммония NH4+)
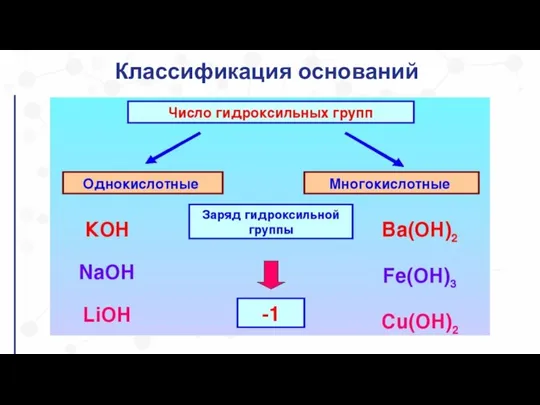
- 3. Классификация оснований
- 4. Классификация оснований по растворимости в воде
- 5. Классификация оснований
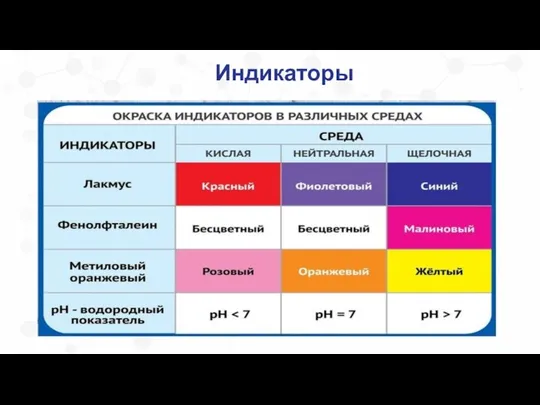
- 6. Индикаторы — вещества, обратимо изменяющие цвет в зависимости от среды раствора. — вещества, обратимо изменяющие цвет
- 7. Индикаторы Самым первым появился индикатор лакмус. Лакмус – это водный настой лакмусового лишайника, растущего на скалах
- 8. Индикаторы
- 9. Окраска индикаторов в щелочной среде
- 10. Нерастворимое основание грязно-зеленого цвета Fe(OH)2
- 11. Нерастворимое основание бурого цвета Fe(OH)3
- 12. Нерастворимое основание синего цвета Cu(OH)2
- 13. Нерастворимое основание зеленого цвета Cr(OH)3
- 14. Нерастворимое амфотерное основание Al(OH)3
- 15. Яркие представители класса оснований, их тривиальные названия и применение Основания используются при производстве моющих средств, мыла,
- 16. NaOH- едкий натр Тривиальное название-каустическая сода Легкоплавкие (tпл = 320 °С) белые гигроскопичные кристаллы и поэтому
- 17. КOH- едкое кали Тривиальное название-каустический поташ Белые гигроскопичные кристаллы, хорошо растворимы в воде. Раствор мылкий на
- 18. Ва(ОН)2- едкий барит Белые гигроскопичные кристаллы. Насыщенный водный раствор гидроксида бария называется баритовой водой. Гидроксид бария
- 19. Са(ОН)2 – гашеная известь Рыхлый белый порошок, малорастворим в воде. Получается при взаимодействии негашёной извести СаО
- 20. Кислоты Кислоты – сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла,
- 21. Классификация кислот
- 22. Классификация кислот
- 23. Классификация кислот
- 24. Классификация кислот
- 25. Бескислородные кислоты
- 26. Кислородсодержащие кислоты
- 27. Кислоты в истории индикаторов Однажды английский химик Р. Бойль, изучая свойства соляной кислоты, закупленной в Германии
- 28. Кислоты
- 29. Определение силы кислоты по формуле Чтобы определить силу кислородсодержащей кислоты HxЭОy, необходимо из числа атомов кислорода
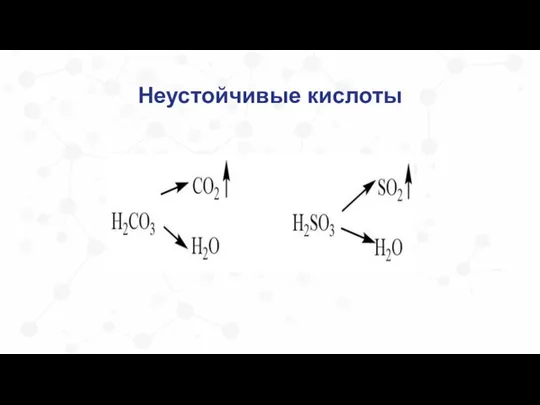
- 30. Неустойчивые кислоты
- 31. Структурные формулы кислот При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот
- 32. Структурные формулы оксокислот При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород с центральным атомом
- 33. Структурные формулы оксокислот (продолжение) 2. К центральному атому (с учетом валентности) присоединяют остальные атомы кислорода, которые
- 34. Окраска индикаторов кислой среде
- 35. Серная кислота H2SO4 При обычных условиях концентрированная серная кислота – тяжёлая маслянистая жидкость без цвета и
- 36. Хлороводородная (соляная) кислота HCl Бесцветная, прозрачная, едкая жидкость. В концентрации около 0,5 % присутствует в желудке
- 37. Oртофосфорная, фосфорная кислота – H3PO4
- 38. Oртофосфорная, фосфорная кислота – H3PO4
- 39. Азотная кислота – HNO3
- 40. Правила приготовления растворов из концентрированных кислот
- 41. Выводы - - - - - Основания – сложные вещества, состоящие из ионов металла и гидроксид-ионов.
- 42. Выводы - - - - Кислоты – сложные вещества, молекулы которых состоят из атомов водорода, способных
- 44. Скачать презентацию






































 Белки, гормоны, антитела, ферменты
Белки, гормоны, антитела, ферменты Аммиак. Урок 58
Аммиак. Урок 58 Алкены – непредельные углеводороды
Алкены – непредельные углеводороды Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть
Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть  Кислород- история открытия, роль в природе
Кислород- история открытия, роль в природе Фракциялық айдау
Фракциялық айдау Аммиак. Физические и химические свойства. Получение и применение
Аммиак. Физические и химические свойства. Получение и применение Виды химической связи
Виды химической связи Бытовая химия в нашей жизни
Бытовая химия в нашей жизни Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Колообіг нітрогену в природі
Колообіг нітрогену в природі Фенолы. Физические свойства
Фенолы. Физические свойства Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть
Презентация по Химии "СТРУКТУРНАЯ ФОРМУЛА КРАХМАЛА" - скачать смотреть  Періодична система Менделєєва. Елементи 6 групи
Періодична система Менделєєва. Елементи 6 групи Химия соединения железа
Химия соединения железа ПОЛЕЗНЫЕ ИЛИ ОПАСНЫЕ
ПОЛЕЗНЫЕ ИЛИ ОПАСНЫЕ Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Общая геология. Породообразующие минералы
Общая геология. Породообразующие минералы Биологическая химия
Биологическая химия Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Количество вещества (8 класс)
Количество вещества (8 класс) Тему «Соли». Нитрат серебра(I) AgNO3
Тему «Соли». Нитрат серебра(I) AgNO3 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Химия в сельском хозяйстве
Химия в сельском хозяйстве Биохимия, как наука
Биохимия, как наука Альдегиды и кетоны
Альдегиды и кетоны Химия
Химия Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов