Содержание
- 2. 1) Железо находится в: а) IV периоде, 8А группе; б) IIIпериоде, 7Б группе; в) IV периоде,
- 3. Топор из метеорита Не так давно в Моравском музее города Брно (Чехия) появился новый экспонат —
- 4. Решите задачу Задача Масса топора 6 килограммов. Топор изготовлен из природнолегированного железа, содержащего 2,8 % никеля,
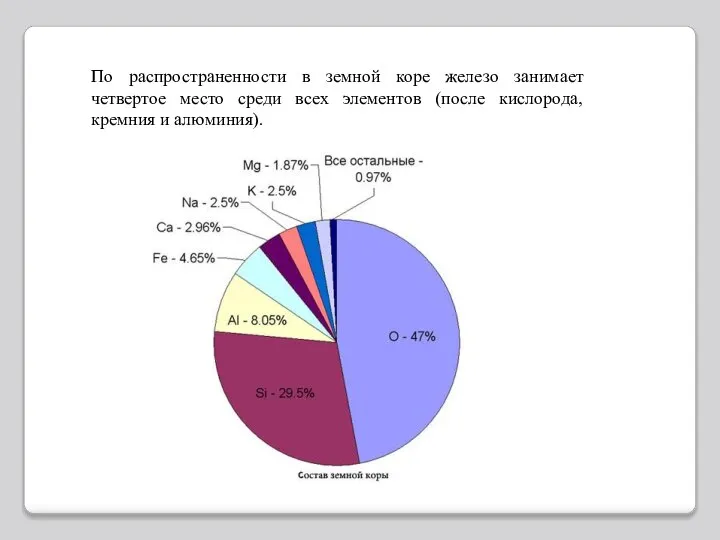
- 5. По распространенности в земной коре железо занимает четвертое место среди всех элементов (после кислорода, кремния и
- 6. ТЕМА: Соединения железа +2, +3 .
- 7. Соединения железа в природе. Минералы – магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк
- 8. Соединения железа ( II) и (III). Оксид железа ( II) FeO, и соответствующий ему гидроксид железа
- 9. Соли железа. Железный купорос FeSO4 *7H2 O Хлорид железа (III) FeCl3 Сульфат железа (III) Fe2 (
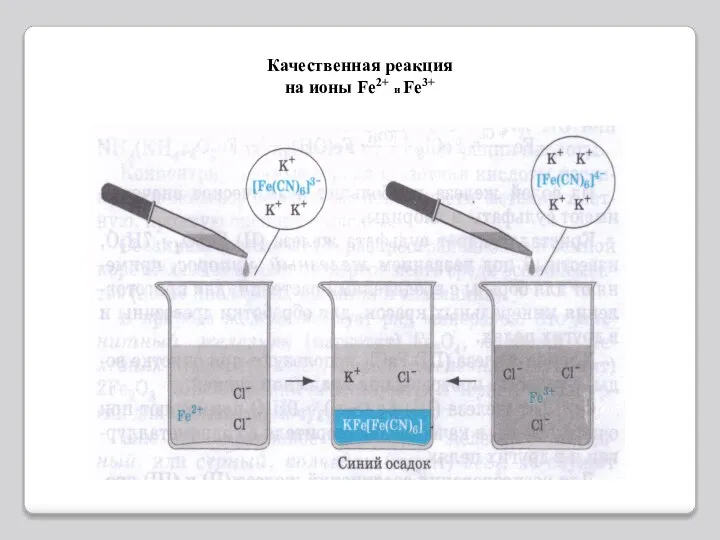
- 10. Качественные реакции. Для обнаружения ионов железа(III) удобно применять комплексное соединение железа, называемое желтой кровяной солью или
- 11. Качественная реакция на ионы Fe2+ и Fe3+
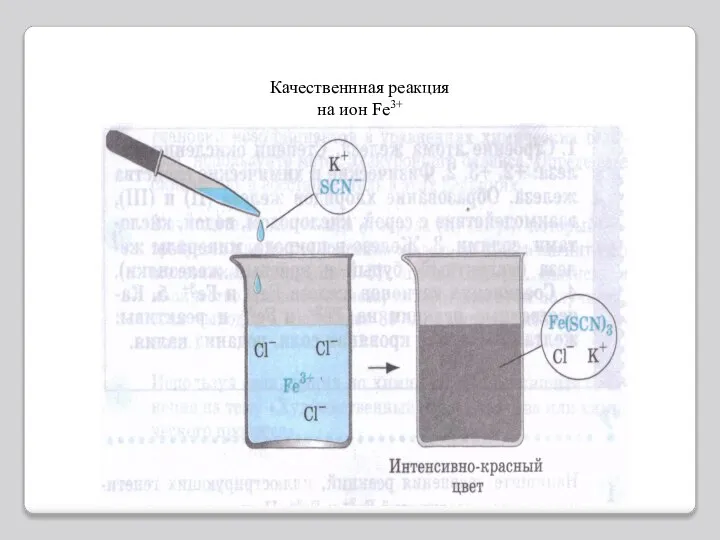
- 12. Качественнная реакция на ион Fe3+
- 14. Скачать презентацию








 « Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес
« Обобщение сведений об основных классах неорганических веществ». « Обобщение сведений об основных классах неорганических вещес Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Получение водорода в промышленности и его применение Химия 8 класс
Получение водорода в промышленности и его применение Химия 8 класс  Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Презентация по Химии "Кальций" - скачать смотреть
Презентация по Химии "Кальций" - скачать смотреть  Способи та засоби припинення та запобігання процесів горіння. Припинення горіння методом охолодження. (Тема 15.24)
Способи та засоби припинення та запобігання процесів горіння. Припинення горіння методом охолодження. (Тема 15.24) Комплексные соединения
Комплексные соединения Органическая химия. История развития
Органическая химия. История развития Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов
Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов Химическая связь
Химическая связь Химия в разных науках
Химия в разных науках Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013
Шлюмберже Бұрғылау жабдығы және жөндеу (БЖ жәнеЖ) Джалал Каримов Атырау 2 шілде, 2013 Электролиз. Правила электролиза
Электролиз. Правила электролиза ФОСФАТНІ ДОБРИВА
ФОСФАТНІ ДОБРИВА  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Подготовили: Сигова Ольга Хетчикова Екатерина
Подготовили: Сигова Ольга Хетчикова Екатерина Фізичні та хімічні явища. (7 клас)
Фізичні та хімічні явища. (7 клас) Таблица Менделеева внутри нас
Таблица Менделеева внутри нас Структура периодической системы элементов
Структура периодической системы элементов Железо в сплавах и природе. Состав железа
Железо в сплавах и природе. Состав железа Презентация по Химии "Молочная кислота" - скачать смотреть _
Презентация по Химии "Молочная кислота" - скачать смотреть _ Адсорбция
Адсорбция Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Термопластичные полимеры
Термопластичные полимеры Эрбий (лат. Erbium)
Эрбий (лат. Erbium) Презентация по Химии "Дисахариди" - скачать смотреть бесплатно
Презентация по Химии "Дисахариди" - скачать смотреть бесплатно