Содержание
- 2. Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно
- 3. Металлургия – это наука, изучающая способы получения металлов из природного сырья.
- 4. К металлургии относятся: Производство металлов из природного сырья и других металлосодержащих продуктов Получение сплавов Обработка металлов
- 5. К металлургии примыкает разработка, производство и эксплуатация машин, аппаратов, агрегатов, используемых в металлургической промышленности. С металлургией
- 6. Разновидности металлургии Чёрная металлургия (добыча и обогащение руд чёрных металлов, производство чугуна, стали и ферросплавов) Цветная
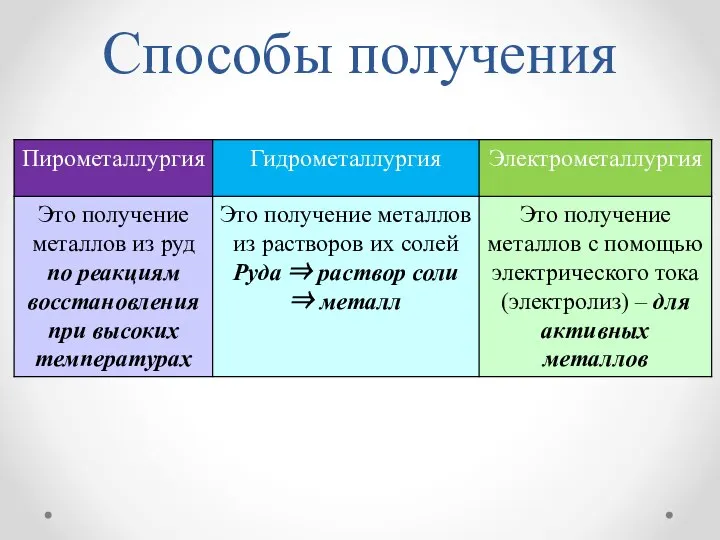
- 7. Способы получения
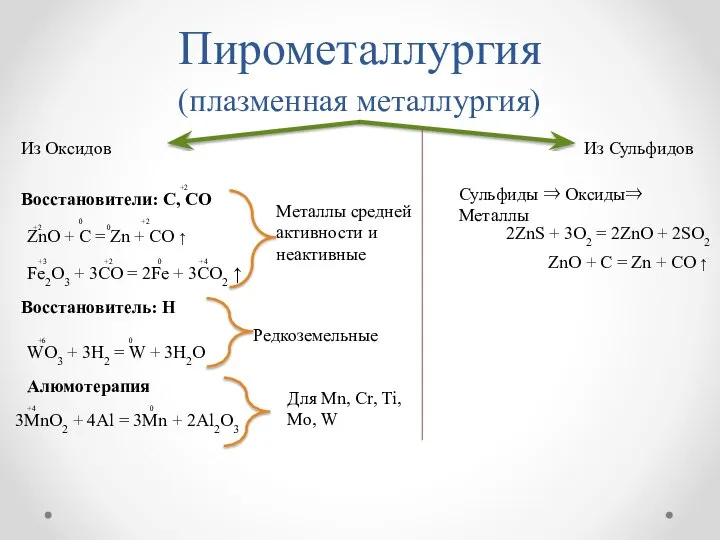
- 8. Пирометаллургия (плазменная металлургия) Из Оксидов Из Сульфидов Сульфиды ⇒ Оксиды⇒ Металлы Восстановитель: Н Алюмотерапия Металлы средней
- 9. Гидрометаллургия CuO + H2SO4 = CuSO4 + H2O (Для Cu, Au, Ag, Zn, Mo, U и
- 10. Электролиз Электролиз – это восстановительный процесс, который возникает на электродах при прохождении электрического тока через раствор
- 11. Электролиз Расплав (жидкое расплавленное состояние вещества при температурах, в определённых границах, удалённых от критической точки плавления
- 12. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 13. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 14. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 15. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 16. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 17. 1. область науки охватывающая процессы получения металлов из руд или других материалов 2. Восстановление при высоких
- 18. Расплав I. Активные металлы 1. Соль активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl−
- 19. Раствор I. Активные металлы 1. Соль активного металла и бескислородной кислоты NaCl ↔ Na+ + Cl−
- 20. Раствор II. Менее активные металлы 1. Соль менее активного металла и бескислородной кислоты ZnCl2 ↔ Zn2+
- 22. Самый теплопроводный металл Самый твёрдый металл Способность материала получать остаточные деформации без разрушения и сохранять их
- 25. Скачать презентацию




















 Полимеры, пластмассы и волокна
Полимеры, пластмассы и волокна Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Химический элементы в нашей жизни
Химический элементы в нашей жизни Застосуваня електролізу
Застосуваня електролізу Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов
Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов Конструкция ферментатора
Конструкция ферментатора Презентация по Химии "Кто хочет стать отличником" - скачать смотреть
Презентация по Химии "Кто хочет стать отличником" - скачать смотреть  Химическая термодинамика
Химическая термодинамика Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет
Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет Основания. Zn(OH)2 гидроксид цинка
Основания. Zn(OH)2 гидроксид цинка Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов NiCl2 - Никель хлориді
NiCl2 - Никель хлориді Биохимия углеводов
Биохимия углеводов Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений
Основы почвоведения, растительный грунт. Изменение физических и химических свойств почв для повышения жизнеспособности растений Аммиак
Аммиак Фармацевтические эмульсии
Фармацевтические эмульсии Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Презентация по химии ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ  Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД Кислоты
Кислоты Металлическая связь
Металлическая связь Природный газ
Природный газ Ферменттер – тіршілік негізі
Ферменттер – тіршілік негізі Возможные роли АФК в старении
Возможные роли АФК в старении Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут)
Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут) студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак
студентка группы ГЭ-1-07 факультета ЭиУ Малышева Е.И. «Биомасса – альтернативный источник энергии» студентка группы ГЭ-1-07 фак Водородный электрод
Водородный электрод