Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Содержание
- 2. ПОРЯДКОВЫЙ НОМЕР ЭЛЕМЕНТА ПОКАЗЫВАЕТ ЧИСЛО ПРОТОНОВ (ЗАРЯД ЯДРА), ЧИСЛО ЭЛЕКТРОНОВ В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ АТОМА. Номер периодов
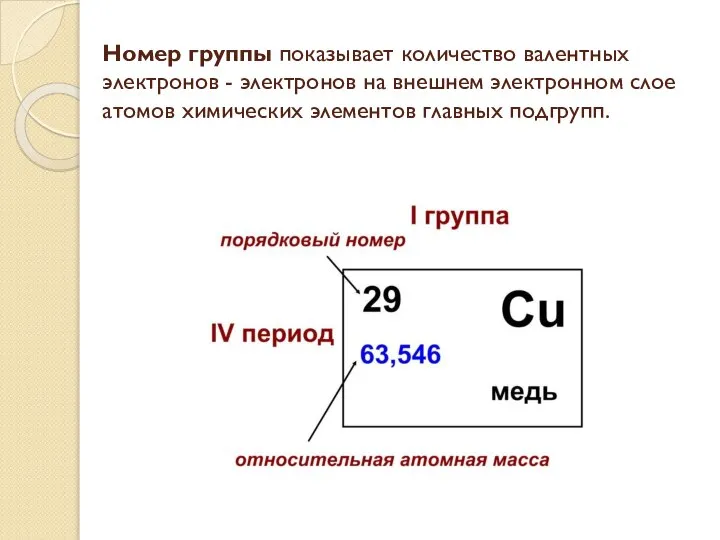
- 3. Номер группы показывает количество валентных электронов - электронов на внешнем электронном слое атомов химических элементов главных
- 4. O – кислород, порядковый номер элемента – 8, относительная атомная масса 15,9994, номер группы- VI, второй
- 5. Закономерности изменения свойств химических элементов и их соединений по периодам и группам Химические свойства элементов (а
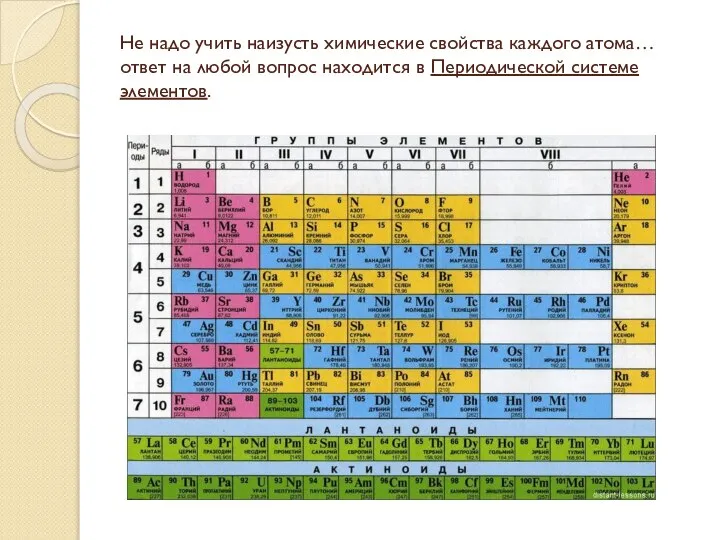
- 6. Не надо учить наизусть химические свойства каждого атома… ответ на любой вопрос находится в Периодической системе
- 7. Изменения свойств химических элементов и их соединений в группах: В группах все элементы имеют сходное электронное
- 8. Закономерность изменения химических свойств элементов и их соединений в группах: В группах сверху вниз возрастают металлические
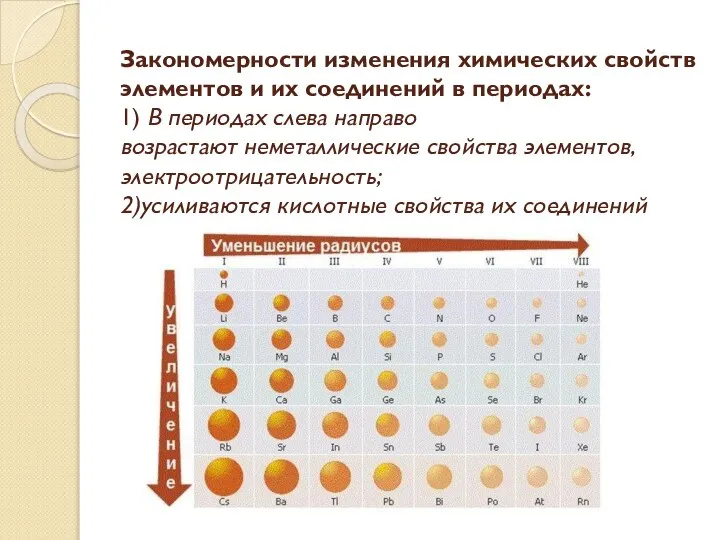
- 9. Закономерности изменения химических свойств элементов и их соединений в периодах: 1) В периодах слева направо возрастают
- 10. Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические
- 11. Подведем итог: С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений
- 13. Скачать презентацию







 синтетичні мийні засоби
синтетичні мийні засоби  Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Лужні метали Підготувала: Анна Сідорова
Лужні метали Підготувала: Анна Сідорова  Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Адсорбция
Адсорбция Массовая доля вещества в растворе
Массовая доля вещества в растворе Виды парфюмерно-косметической косметики
Виды парфюмерно-косметической косметики Классификация органических соединений
Классификация органических соединений Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Атомы и молекулы
Атомы и молекулы Рибонуклеиновая кислота
Рибонуклеиновая кислота Распределение электронов в атомах. Энергетические уровни
Распределение электронов в атомах. Энергетические уровни Химия в пищевой промышленности
Химия в пищевой промышленности Коррозия металлов в контакте
Коррозия металлов в контакте Оружие массового поражения. Биологическое оружие
Оружие массового поражения. Биологическое оружие  Абразивные материалы
Абразивные материалы Условия проведения реакции дегидратации
Условия проведения реакции дегидратации Интоксикации сельскохозяйственными ядохимикатами (пестицидами)
Интоксикации сельскохозяйственными ядохимикатами (пестицидами) Неорганическая химия Сероводород
Неорганическая химия Сероводород  Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія
Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія  Корень как часть слова
Корень как часть слова  Синтез наночастиц неорганических веществ. (Лекция 7)
Синтез наночастиц неорганических веществ. (Лекция 7) 3 Стехиометрические законы
3 Стехиометрические законы Спирты Предельные одноатомные спирты
Спирты Предельные одноатомные спирты Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Презентация по Химии "Цветная металлургия" - скачать смотреть
Презентация по Химии "Цветная металлургия" - скачать смотреть  Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Основы коррозии и защиты металлов
Основы коррозии и защиты металлов