Содержание
- 2. Периодическая система Д. И. Менделеева — это графическое выражение Периодического закона. Существует множество различных модификаций Периодической
- 3. Порядковый номер элемента, номер периода и номер группы в Периодической системе Д. И. Менделеева
- 4. Номер группы Номер группы указывает на число электронов на внешнем энергетическом уровне атомов для элементов главных
- 5. Валентными называют электроны
- 6. Валентными называют электроны, которые могут принимать участие в образовании химической связи. Для элементов главных подгрупп такими
- 7. В пределах одного и того же периода
- 8. В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются, так как: а)
- 9. В пределах одной и той же группы (в главной подгруппе)
- 10. пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают, так
- 11. В больших периодах (4—6) эти изменения происходят более медленно,
- 13. Скачать презентацию










 Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Возведение наземных стальных резервуаров
Возведение наземных стальных резервуаров Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения
Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения Штучні і синтетичні волокна
Штучні і синтетичні волокна  Теория горения горючих дисперсных материалов
Теория горения горючих дисперсных материалов  Вода. Растворы. Растворение
Вода. Растворы. Растворение Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Химическая Кинетика
Химическая Кинетика Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Инертные газы
Инертные газы Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Практическое применение метанола
Практическое применение метанола Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары
Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары Презентация по Химии "портфоліо" - скачать смотреть
Презентация по Химии "портфоліо" - скачать смотреть  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода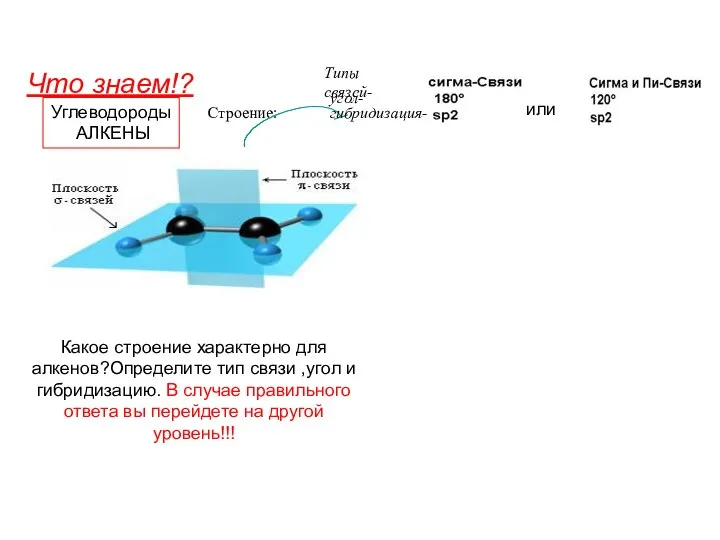 Углеводороды. Алкены
Углеводороды. Алкены Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Состав энергетических напитков
Состав энергетических напитков Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Наполненные полимеры. Структура и физико-химические свойства. Введение
Наполненные полимеры. Структура и физико-химические свойства. Введение Биохимия печени
Биохимия печени