Содержание
- 2. Периодическая система Закономерности изменения свойств
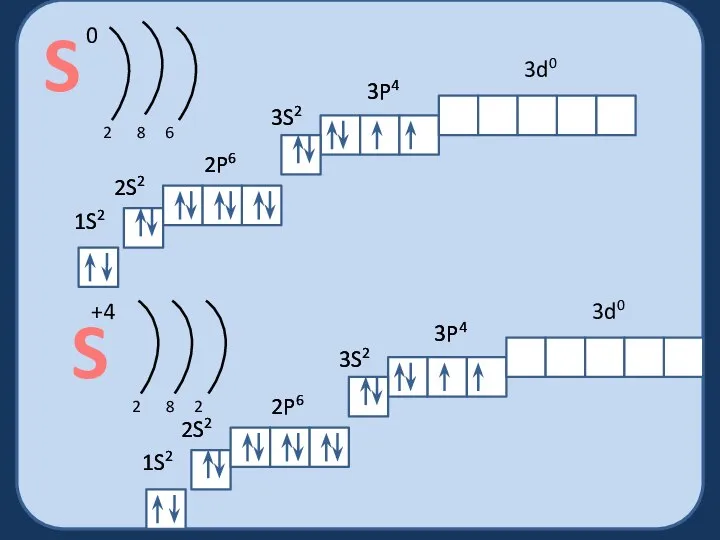
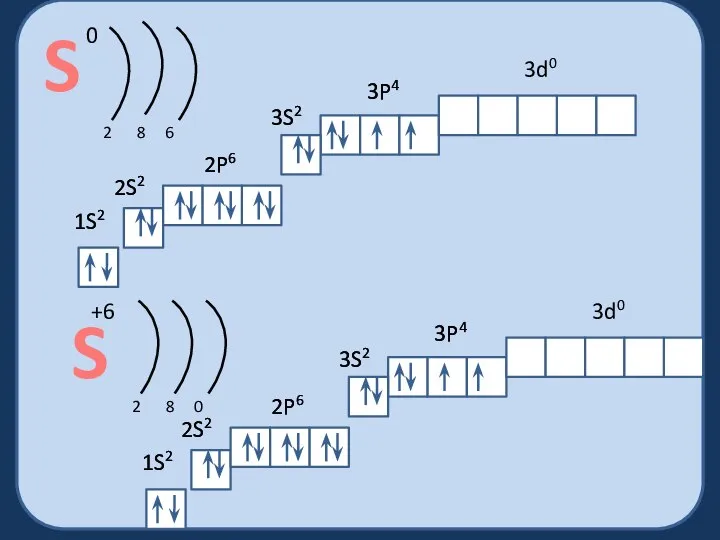
- 3. СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК У ИОНОВ
- 5. 1S2 2S2 2P6 3S2 3P4 3d0 1S2 2S2 2P6 3S2 3P4
- 6. 1S2 2S2 2P6 3S2 3P4 3d0 1S2 2S2 2P6 3S2 3P4
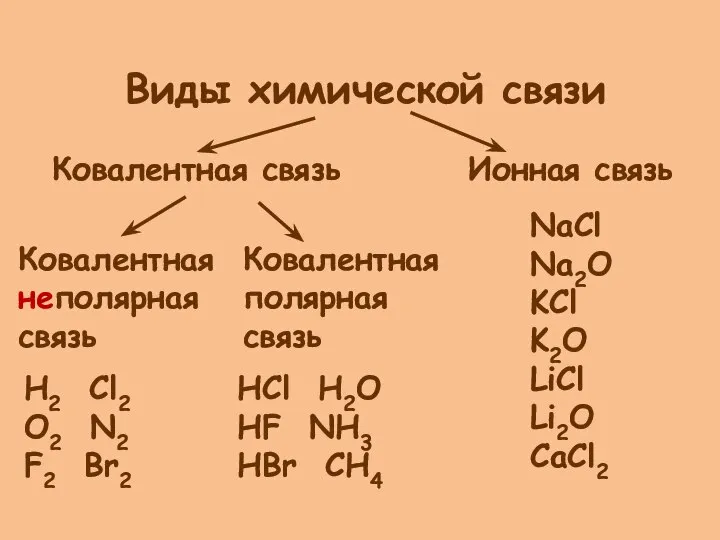
- 7. Виды химической связи Ковалентная связь Ионная связь Ковалентная неполярная связь Ковалентная полярная связь NaCl Na2O KCl
- 8. Ковалентная неполярная связь
- 10. Степень окисления NH3 NH4+ OF2 NaH (NH4)2SO4 , CuNO3 , Cu(NO3)2 , Ca3(PO4)2
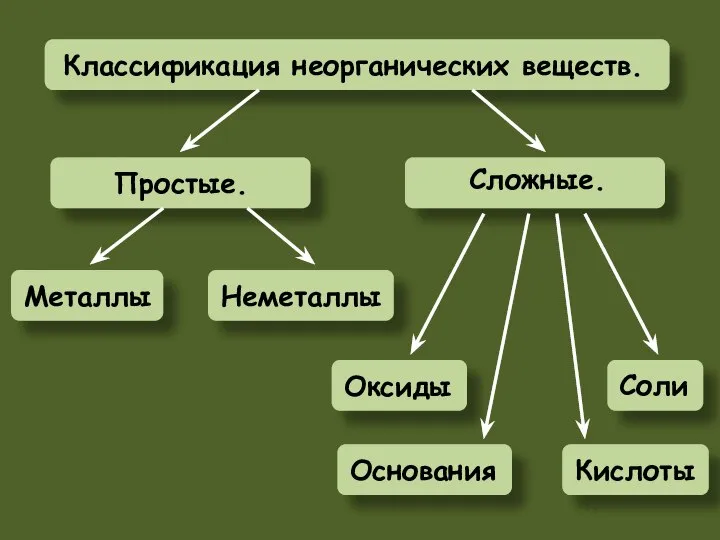
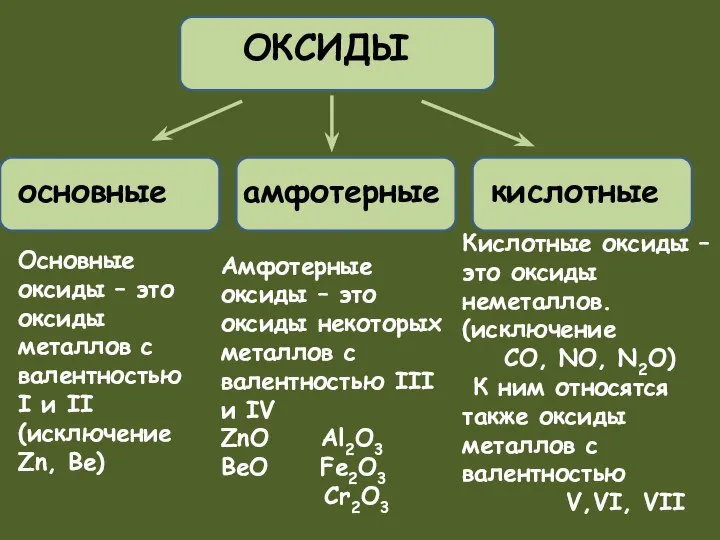
- 12. Основные оксиды – это оксиды металлов с валентностью I и II (исключение Zn, Be) Амфотерные оксиды
- 14. Генетический ряд металлов.
- 15. Генетический ряд неметаллов.
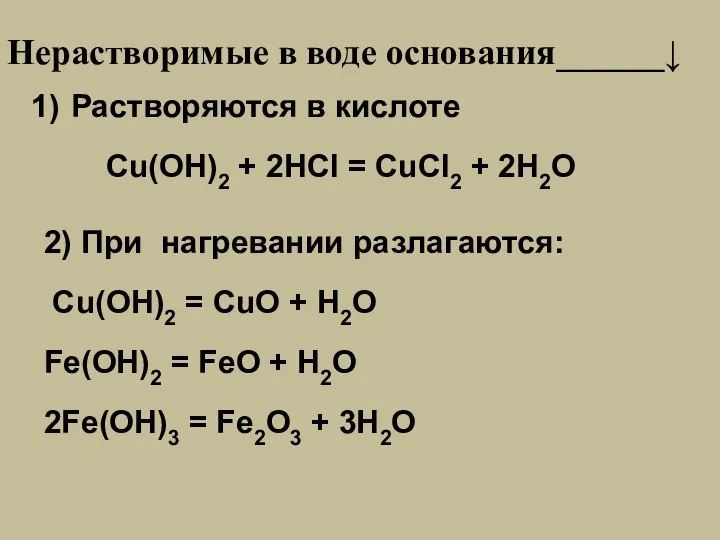
- 17. Нерастворимые в воде основания______↓ Растворяются в кислоте Cu(OH)2 + 2HCl = CuCl2 + 2H2O 2) При
- 18. СОЛИ Взаимодействие с металлами 2) Взаимодействие с растворимыми в воде основаниями 3) Взаимодействие с растворимыми в
- 19. Галогены
- 20. Химические свойства. При взаимодействии галогенов с металлами образуются соли – галогениды. Zn + F2 = ZnF2
- 21. Химические свойства При взаимодействии галогенов с водородом образуются галогеноводороды (при растворении в воде галогеноводороды образуют кислоты)
- 22. Химические свойства Cl2, Br2, I2 взаимодействуют по схеме: Гal2 + H2O = HГalО + НГal Cl2
- 23. Химические свойства Более активный галоген вытесняет менее активный из растворов солей. F2 > Cl2 > Br2
- 24. Химические свойства.
- 25. Химические свойства оксидов серы.
- 26. Химические свойства. учебник, стр.89 – 91
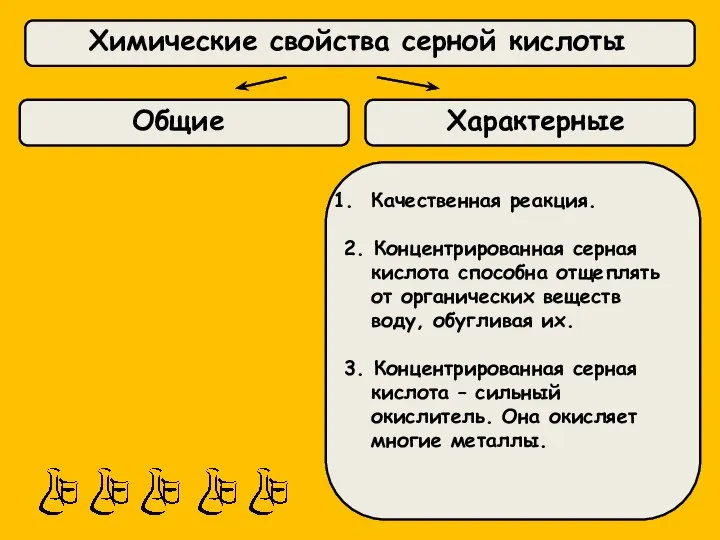
- 27. Химические свойства серной кислоты Общие Характерные Качественная реакция. 2. Концентрированная серная кислота способна отщеплять от органических
- 29. Химические свойства азота
- 30. Химические свойства азота 1. Взаимодействие с металлами: 6 Li + N2 = 2 Li3N 2. Взаимодействие
- 31. Химические свойства аммиака 1. Взаимодействие с водой: 2. Взаимодействие с кислотами:
- 32. Химические свойства аммиака 1. Взаимодействие с водой: 2. Взаимодействие с кислотами:
- 33. Химические свойства аммиака 1. Взаимодействие с водой: 2. Взаимодействие с кислотами:
- 34. Химические свойства аммиака 3. Горение аммиака: 4. Каталитическое окисление аммиака:
- 35. Химические свойства аммиака 3. Горение аммиака: 4. Каталитическое окисление аммиака:
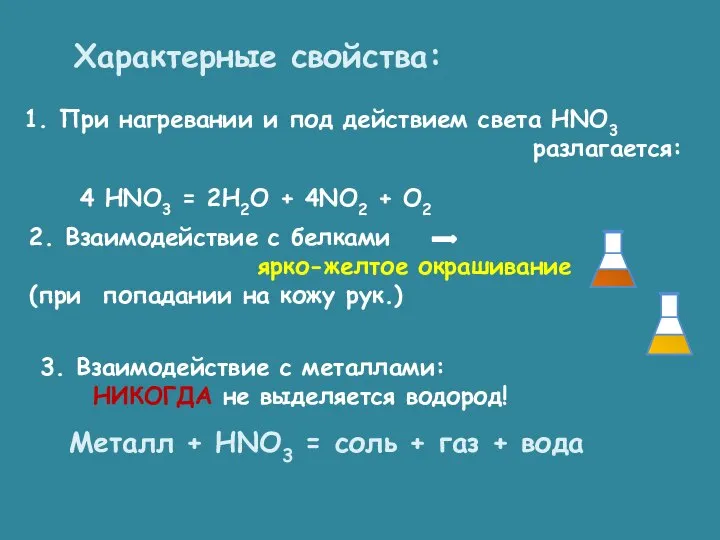
- 36. Характерные свойства: 1. При нагревании и под действием света HNO3 разлагается: 4 HNO3 = 2H2O +
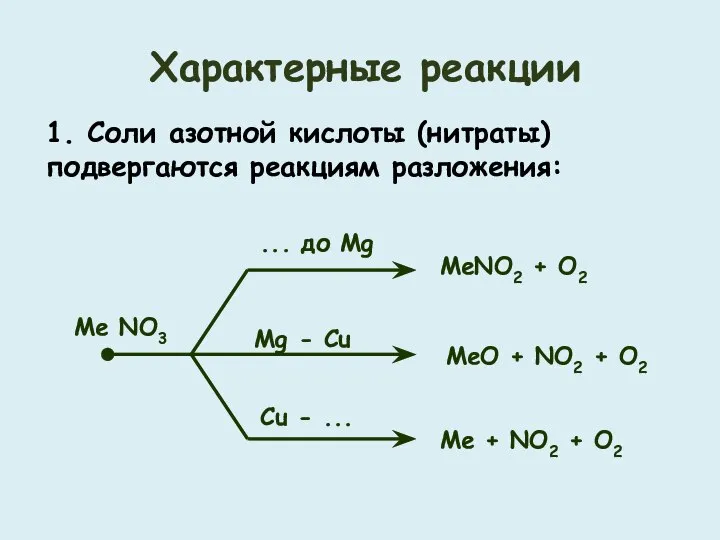
- 38. Характерные реакции 1. Соли азотной кислоты (нитраты) подвергаются реакциям разложения:
- 39. Химические свойства углерода:
- 41. I. Взаимодействие с простыми веществами.
- 42. I. Взаимодействие с простыми веществами.
- 43. I. Взаимодействие с простыми веществами.
- 44. II. Взаимодействие со сложными веществами.
- 45. II. Взаимодействие со сложными веществами.
- 47. К раствору карбоната калия массой 27, 6 г и массовой долей 10% прилили избыток раствора нитрата
- 49. Скачать презентацию





































 Предмет органической химии
Предмет органической химии Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Стратегия успеха 2 (ЕГЭ). Органическая химия
Стратегия успеха 2 (ЕГЭ). Органическая химия Оксид фосфора
Оксид фосфора Вещества и их свойства
Вещества и их свойства Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть
Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть  Кислая, нейтральная и щелочная среда. (Лекция 2)
Кислая, нейтральная и щелочная среда. (Лекция 2) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица
Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица  Химическая кинетика
Химическая кинетика Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу Химические свойства металлов
Химические свойства металлов Презентация по Химии "Полимеразная цепная реакция(ПЦР)" - скачать смотреть
Презентация по Химии "Полимеразная цепная реакция(ПЦР)" - скачать смотреть  Нафта. Переробка нафти Виконала: ліцеїстка ІІІ-І курсу Гринюк Ольга
Нафта. Переробка нафти Виконала: ліцеїстка ІІІ-І курсу Гринюк Ольга  Підготувала учениця 10-Б класу Березянська Альона
Підготувала учениця 10-Б класу Березянська Альона  Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна  Строение периодической системы. Знаки химических элементов
Строение периодической системы. Знаки химических элементов Спирты. Фенолы. Альдегиды. Карбоновые кислоты
Спирты. Фенолы. Альдегиды. Карбоновые кислоты Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17)
Биохимия эритроцитов, гемоглобина и лейкоцитов. Кровь. (Лекция 17) Комплексные соединения
Комплексные соединения Матричные биосинтезы
Матричные биосинтезы Курсовая работа: синтез 3,5-диметилпиразола
Курсовая работа: синтез 3,5-диметилпиразола Практична робота Виведення плям від чаю
Практична робота Виведення плям від чаю  «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА»  Растворы. Первичные понятия
Растворы. Первичные понятия Азот. Нахождение азота в природе
Азот. Нахождение азота в природе Теоретические основы химической технологии
Теоретические основы химической технологии Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии