Содержание
- 2. В таблице – более 100 элементов В 2000 открыт 114 элемент- путем бомбардировки на циклотроне У-400
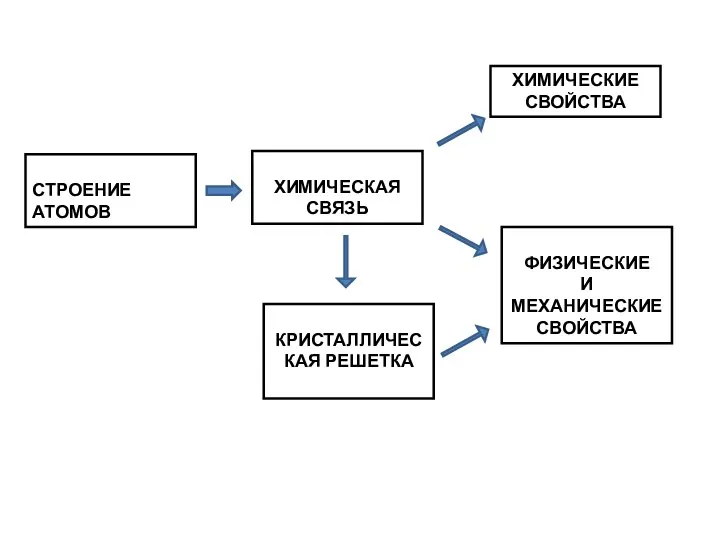
- 3. СТРОЕНИЕ АТОМОВ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА ХИМИЧЕСКАЯ СВЯЗЬ ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА ХИМИЧЕСКИЕ СВОЙСТВА
- 4. Современная формулировка закона: свойства простых веществ, а также формы и свойства их соединений элементов находятся в
- 5. Свойства элементов определяются: зарядом ядра его атомов атомным радиусом - числом электронов на внешней оболочке
- 6. Атомный номер элемента (физический смысл): Атомный номер элемента показывает заряд ядра элемента, число протонов, число электронов
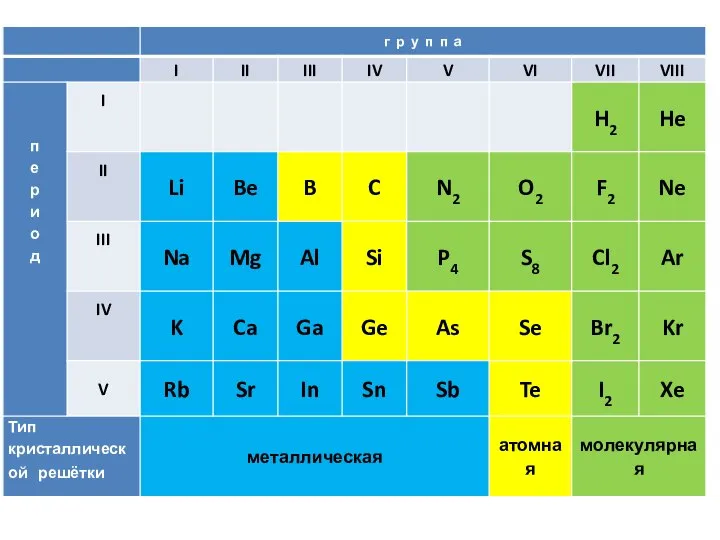
- 7. Периоды – горизонтальные ряды таблицы. Малые (2 – в I или 8 – во II и
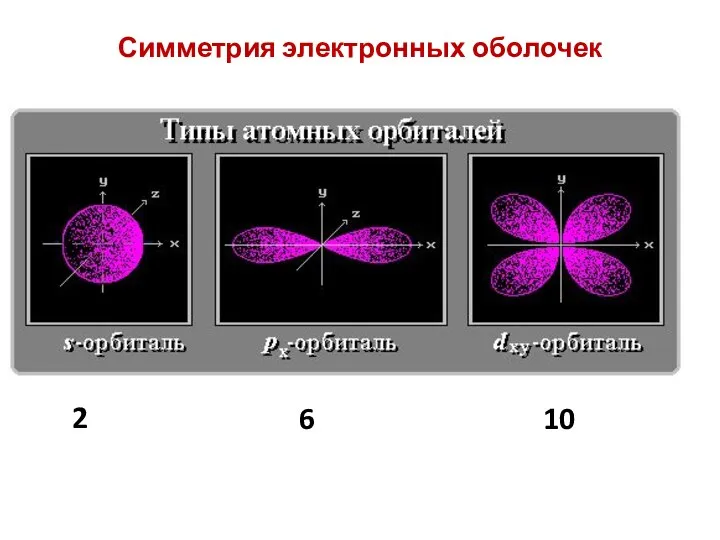
- 8. Симметрия электронных оболочек 2 6 10
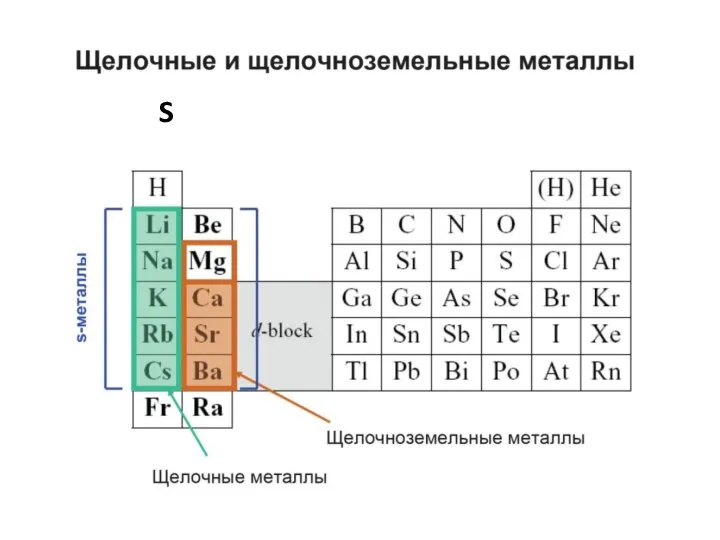
- 9. s- элементы – в начале периодов; все s- элементы – металлы; самые активные металлы – щелочные
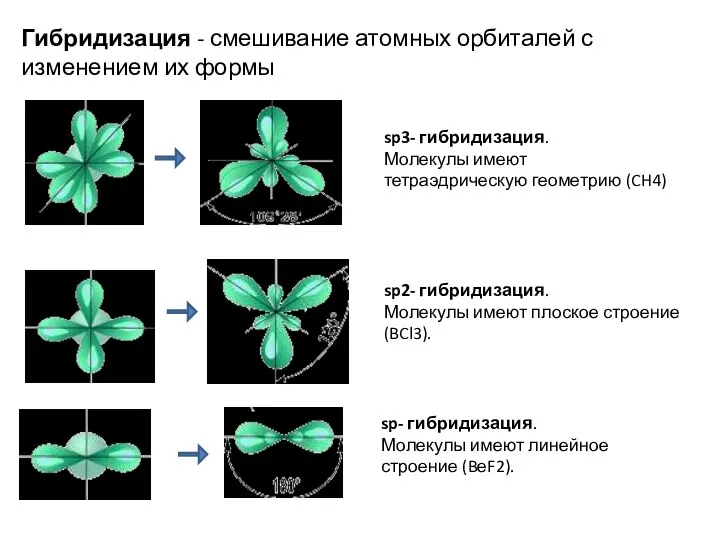
- 10. Гибридизация - смешивание атомных орбиталей с изменением их формы sp3- гибридизация. Молекулы имеют тетраэдрическую геометрию (CH4)
- 11. Периодические закономерности Горизонтальная Вертикальная Диагональная
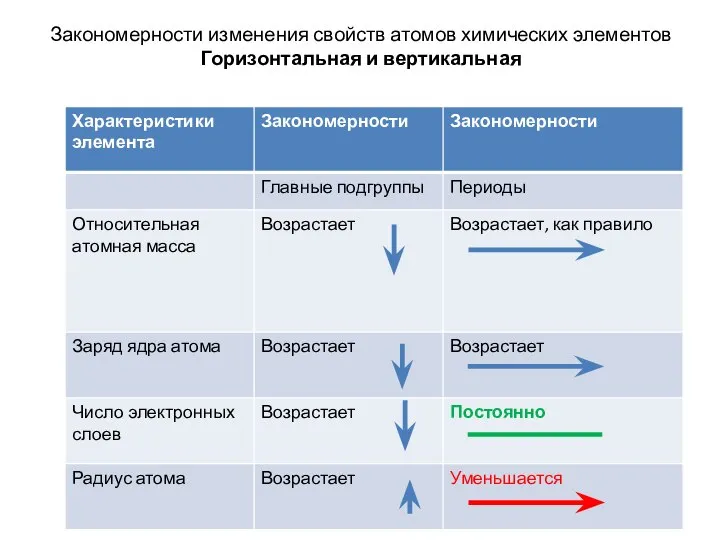
- 12. Закономерности изменения свойств атомов химических элементов Горизонтальная и вертикальная
- 13. Закономерности связанные с валентностью Валентность - способность атомов элементов образовывать определённое число химических связей с атомами
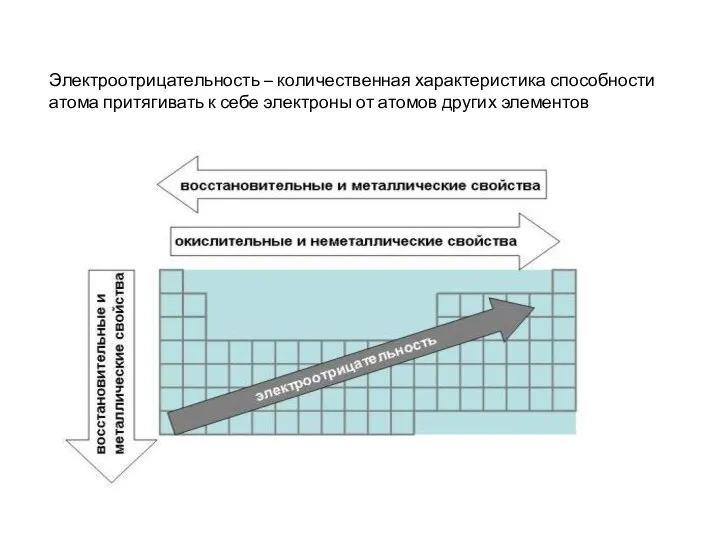
- 14. Электроотрицательность – количественная характеристика способности атома притягивать к себе электроны от атомов других элементов
- 15. Электроотрицательность - способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании
- 16. Кристаллические решетки веществ – упорядоченное расположение частиц (атомов, ионов, молекул) в строго определенных точках пространства. Точки
- 17. Химические связи Межмолекулярная, водородная Ионная – электроотрицательности атомов сильно различаются- один легко отдает, а другой легко
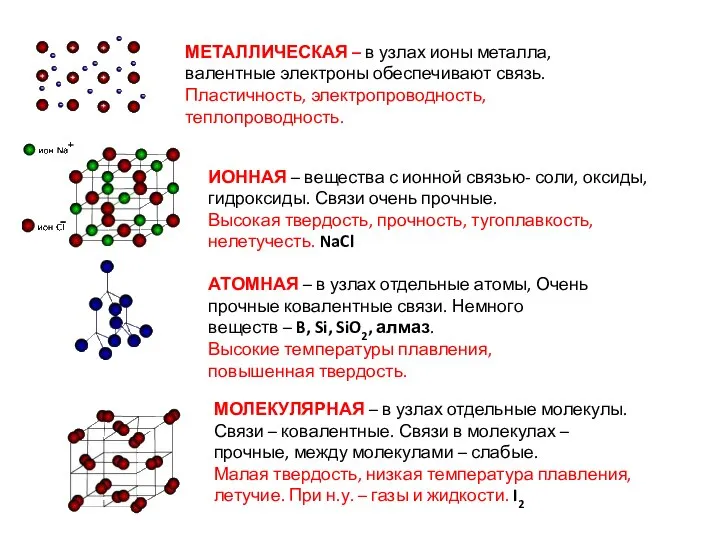
- 18. МЕТАЛЛИЧЕСКАЯ – в узлах ионы металла, валентные электроны обеспечивают связь. Пластичность, электропроводность, теплопроводность. ИОННАЯ – вещества
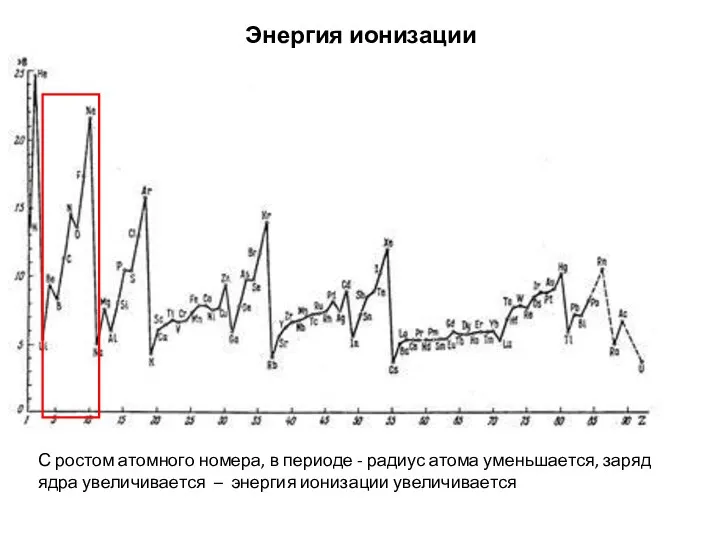
- 20. Энергия ионизации С ростом атомного номера, в периоде - радиус атома уменьшается, заряд ядра увеличивается –
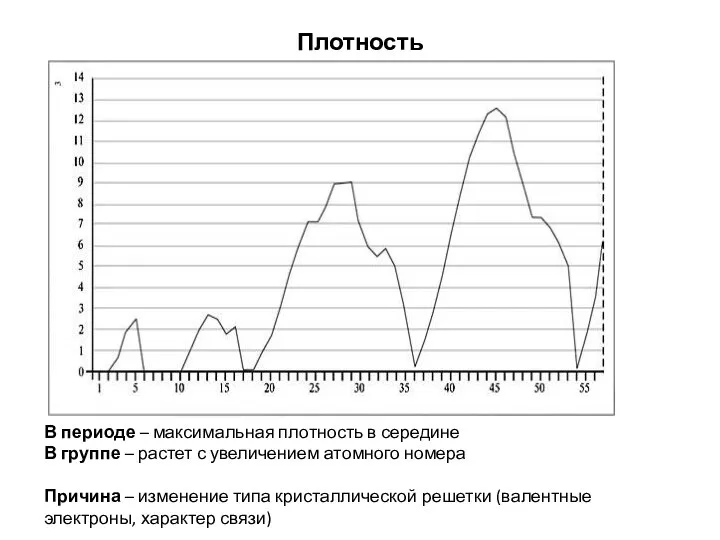
- 21. Плотность В периоде – максимальная плотность в середине В группе – растет с увеличением атомного номера
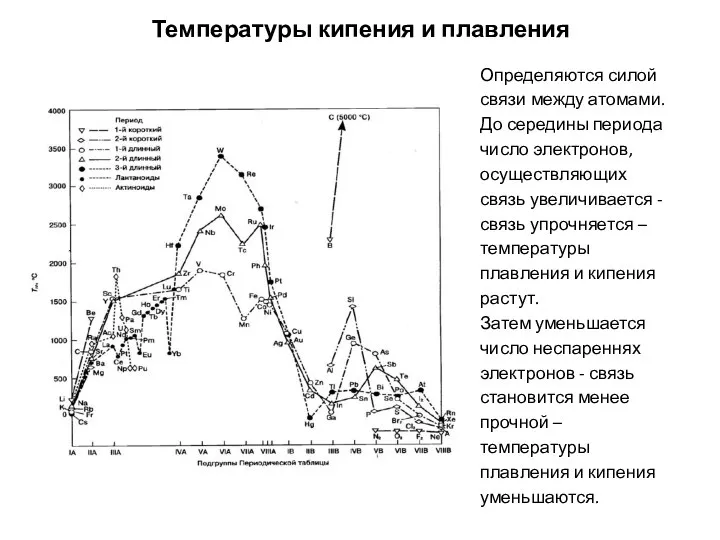
- 22. Температуры кипения и плавления Определяются силой связи между атомами. До середины периода число электронов, осуществляющих связь
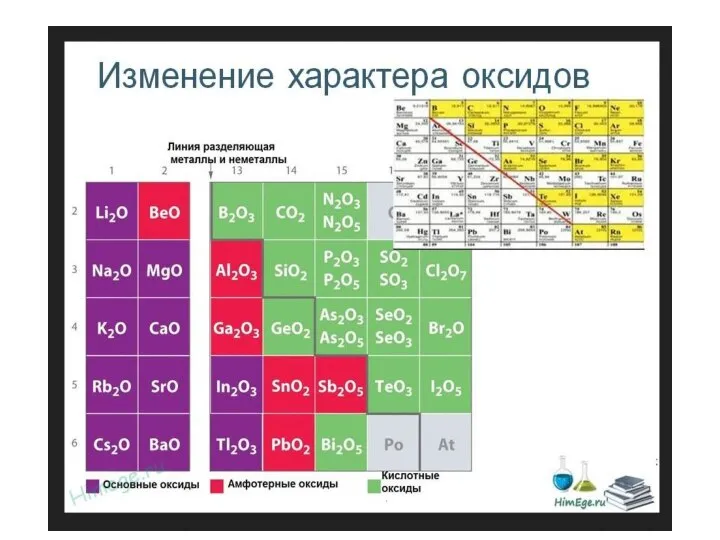
- 23. Горизонтальная закономерность – в периоде с ростом порядкового номера металлические свойства ослабевают, неметаллические усиливаются. Вертикальная закономерность
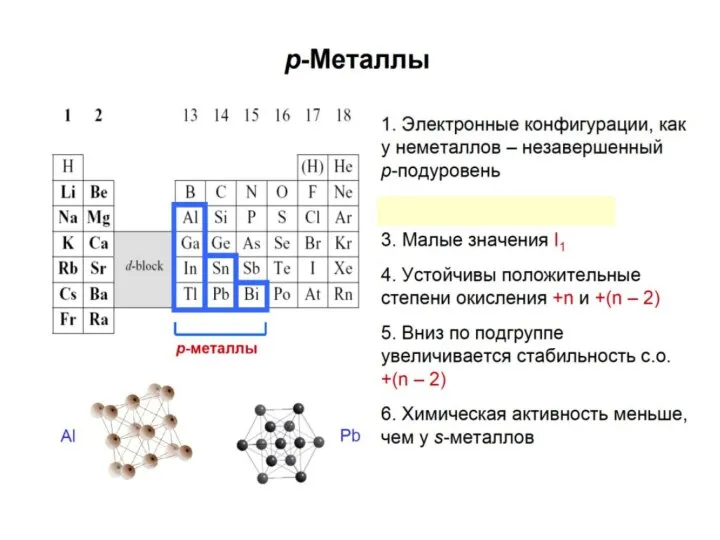
- 24. S
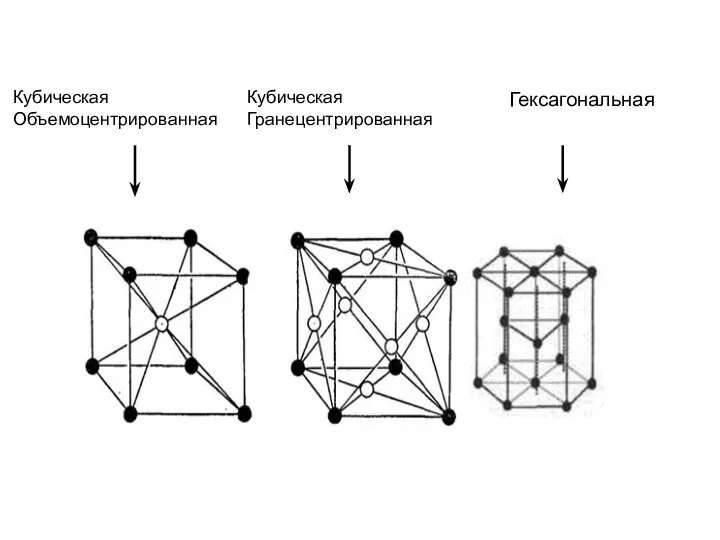
- 28. Гексагональная Кубическая Объемоцентрированная Кубическая Гранецентрированная
- 29. Кубическая объемоцентрированная ? Низкие t0 плавления и кипения, малая твёрдость Кубическая гранецентрированная ? Высокая пластичность Гексагональная
- 30. Металлы с одним типом решетки
- 31. Металлы с полиморфным превращением
- 32. Анизотропия металлов. В кристаллических решетках атомная плотность по различным плоскостям неодинакова — на единицу площади разных
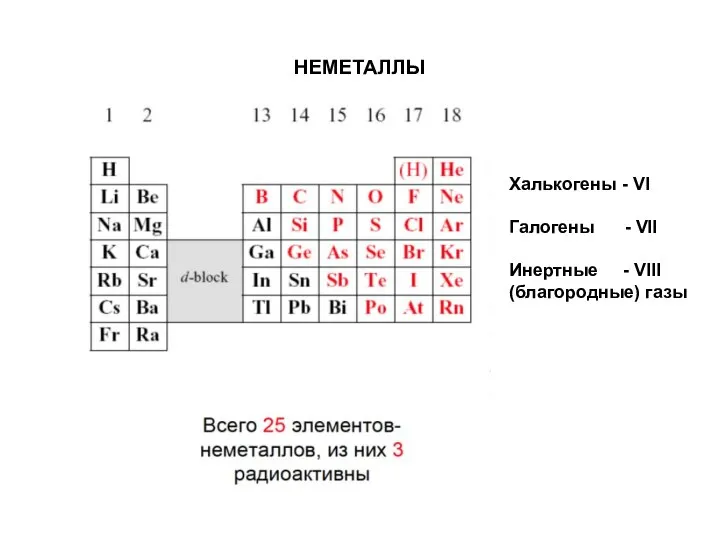
- 33. НЕМЕТАЛЛЫ Халькогены - VI Галогены - VII Инертные - VIII (благородные) газы
- 34. ВОДОРОД. ГИДРИДЫ. ТИПЫ ГИДРИДОВ: Металлические. Сплавы металлического водорода с металлами (почти все переходные металлы). Высокие температуры
- 35. ВОДОРОДНАЯ ЭНЕРГЕТИКА
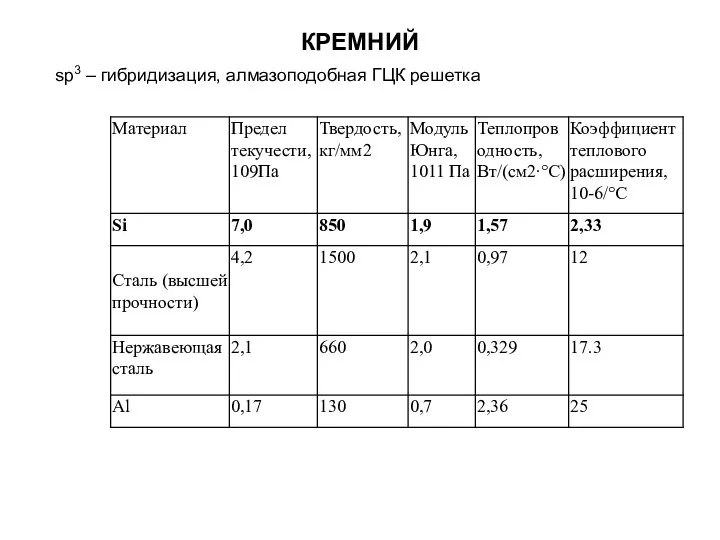
- 37. КРЕМНИЙ sp3 – гибридизация, алмазоподобная ГЦК решетка
- 38. Токсичные элементы
- 40. Скачать презентацию



















 Производство серной кислоты
Производство серной кислоты Химия высокомолекулярных соединений (ВМС)
Химия высокомолекулярных соединений (ВМС) Особенности органических реакций
Особенности органических реакций Растительные жиры. Пальмовое масло
Растительные жиры. Пальмовое масло Химия: основные законы
Химия: основные законы Интерактивное пособие по химии
Интерактивное пособие по химии Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ
Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть
Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть  Лекарственные растения и сырье, содержащие витамины. (Лекция 5)
Лекарственные растения и сырье, содержащие витамины. (Лекция 5) Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение)
Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение) Экология микроорганизмов. (Лекция 8)
Экология микроорганизмов. (Лекция 8) Кетоны
Кетоны Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14 Презентация на тему Экологические проблемы Казахстана
Презентация на тему Экологические проблемы Казахстана  Технология приготовления липосомальных форм лекарственных препаратов и их применение
Технология приготовления липосомальных форм лекарственных препаратов и их применение Компьютерные программы для оценки устойчивости, биоконцентрирования и токсичности химических веществ
Компьютерные программы для оценки устойчивости, биоконцентрирования и токсичности химических веществ Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Цікаві факти про хімію
Цікаві факти про хімію Реакция Пфитцингера
Реакция Пфитцингера Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Химическая промышленность Беларуси
Химическая промышленность Беларуси Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Хімічні властивості алканів
Хімічні властивості алканів Основания. Общая характеристика
Основания. Общая характеристика Растворы. Теория электролитической диссоциации (лекция 6)
Растворы. Теория электролитической диссоциации (лекция 6)