Содержание
- 2. План Классификация электрохимических методов анализа. Потенциометрия. Потенциометрическое титрование. Кондуктометрия. Кондуктометрическое титрование. Кулонометрия. Кулонометрическое титрование. Литература: Харитонов
- 3. 1. Классификация электрохимических методов анализа. Электрохимические методы анализа совокупность методов качественного и количественного анализа веществ, основанные
- 4. Электрохимические методы основаны на измерении электрических параметров электрохимических явлений, возникающих в исследуемом растворе. Такое измерение осуществляют
- 5. Миниатюрная электрохимическая ячейка, имитирующая физико-химические процессы метаболизма, проходящие в человеческом теле, была разработана и создана учеными
- 6. Анализатор ФАРАДЕЙ-5104 Области применения: экологический контроль загрязнений окружающей среды (воды, воздуха, почвы); анализ пищевых продуктов и
- 7. Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. По природе источника электрической
- 8. В методах без наложения постороннего потенциала электрохимическая ячейка представляет собой гальванический элемент, в котором вследствие протекания
- 9. II. По способу применения электрохимических методов, различают прямые и косвенные методы: прямые, в которых концентрацию веществ
- 10. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т.д.
- 11. бихроматное окисление с прямой потенциометрией В приборах с наложением внешнего потенциала важной частью являются устройства для
- 12. 2. Потенциометрия. Потенциометрическое титрование.
- 13. Электрод предназначен для измерения величины pH в лабораторных условиях (без использования электродов сравнения).
- 14. Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и
- 17. Электроды второго рода чувствительны к анионам (обратимы по аниону). Различают следующие виды электродов II рода: а)
- 21. Инертные электроды – пластина или проволока, изготовленная из трудноокисляемых металлов – платины, золота, палладия. Применяются они
- 22. Мембранные или ион-селективные электроды – электроды, обратимые по катионам или анионам, сорбируемым твердой или жидкой мембраной,
- 23. Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело
- 24. Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода и электрода сравнения, опускают в анализируемый
- 25. Наиболее часто потенциометры применяют для прямых измерений рН, показатели концентраций других ионов pNa, pK, pNH4, pCl
- 26. Потенциометрическое титрование Потенциометрическое титрование проводят в тех случаях, когда химические индикаторы использовать нельзя или при отсутствии
- 28. Потенциометрическое титрование применяют во всех случаях титриметрического анализа. При кислотно-основном титровании используют стеклянный электрод и электрод
- 29. При осадительном потенциометрическом титровании применяют в качестве индикатора электрод из металла, составляющего с определяемыми ионами электродную
- 30. При комплексометрическом титровании используют: а) металлический электрод, обратимый к иону определяемого металла; б) платиновый электрод при
- 31. При окислительно-восстановительном титровании применяют электрод сравнения и платиновый индикаторный электрод, чувствительный к окислительно-восстановительным парам.
- 32. Потенциометрическое титрование – один из наиболее употребляемых методов инструментального анализа вследствие простоты, доступности, селективности и широких
- 33. 3. Кондуктометрия. Кондуктометрическое титрование
- 34. Кондуктометрический анализ проводят с помощью кондуктометров – приборов, измеряющих сопротивление растворов.
- 35. Определение концентрации растворов осуществляют прямой кондуктометрией и кондуктометрическим титрованием. Чаще применяют кондуктометрическое титрование.
- 36. Кондуктометрическое титрование обладает рядом преимуществ: его можно проводить в мутных и окрашенных средах, в отсутствии химических
- 37. В кислотно-основном титровании кондуктометрическим путем можно определять сильные кислоты, слабые кислоты, соли слабых оснований и сильных
- 38. 4. Кулонометрия. Кулонометрическое титрование В кулонометрии вещества определяют измерением количества электричества, затраченного на их количественное электрохимическое
- 39. Q –количество электричества, прошедшего при электролизе через электрохимическую ячейку, Кл; M - молярная масса вещества, прореагировавшего
- 40. Различают кулонометрию прямую и кулонометрическое титрование. Высокая точность и чувствительность методов измерения электрического тока обеспечивает кулонометрическому
- 41. В отличии от других методов анализа кулонометрия может быть полностью автоматизирована, что сводит к минимуму случайные
- 43. Скачать презентацию








































 Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Химия в сельском хозяйстве.
Химия в сельском хозяйстве.  Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті
Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Методы анализа вещества
Методы анализа вещества Типы химических реакций в неорганической и органической химии
Типы химических реакций в неорганической и органической химии Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана
Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна
Проект – дослідження мило Dove Роботу виконала учениця 11 класу Бабенко Аліна Віталіївна  Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Многоликая уксусная кислота
Многоликая уксусная кислота Распознавание химических соединений
Распознавание химических соединений Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.
Формирование ответственного отношения школьников к окружающей среде родного края на уроках химии и во внеурочное время.  Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3) Глюкоза, ее строение и свойства
Глюкоза, ее строение и свойства Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно
Презентация по Химии "ЛИПИДНЫЙ ОБМЕН" - скачать смотреть бесплатно Строение атома
Строение атома Коррозия железа
Коррозия железа Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман
Презентація на тему: “Нітратна кислота” Підготував: Учень 10-А класу Луцької ЗОШ № 25 Матвійчук Роман  Искусственные или технические битумы
Искусственные или технические битумы Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Оксид фосфора P2O5
Оксид фосфора P2O5 Методы выращивания кристаллов
Методы выращивания кристаллов Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Химические свойства алкадиенов и алкинов
Химические свойства алкадиенов и алкинов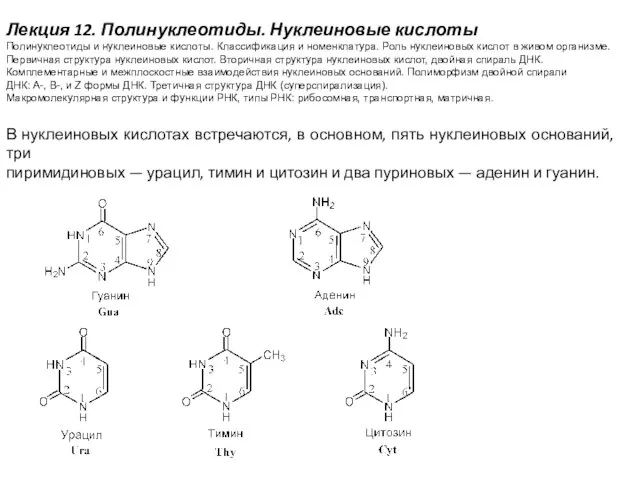 Полинуклеотиды. Нуклеиновые кислоты
Полинуклеотиды. Нуклеиновые кислоты