Содержание
- 2. В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака: величину
- 3. При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают),
- 4. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 5. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 6. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА Современная трактовка Периодического закона: Свойства химических элементов и образуемых ими соединений находятся
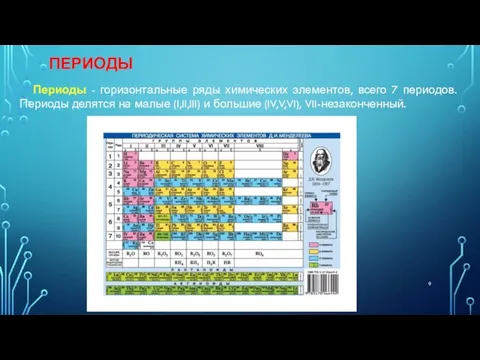
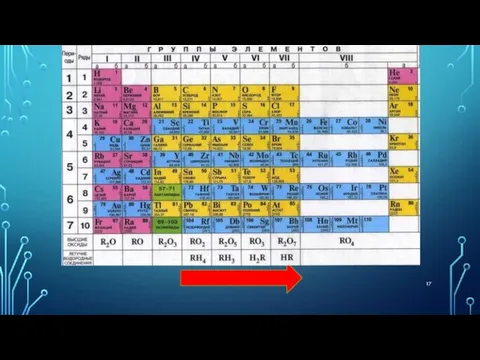
- 9. ПЕРИОДЫ Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и
- 10. ПЕРИОДЫ Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и
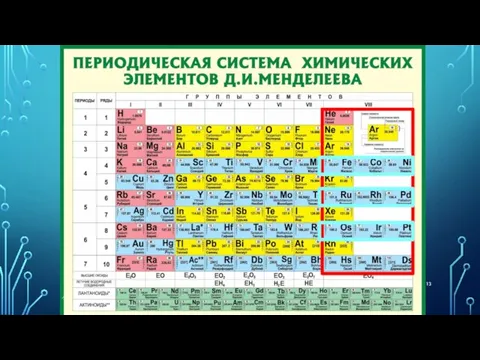
- 11. ГРУППЫ вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
- 12. ГРУППЫ Различают главные (А) и побочные подгруппы (Б). Главные подгруппы состоят из элементов малых и больших
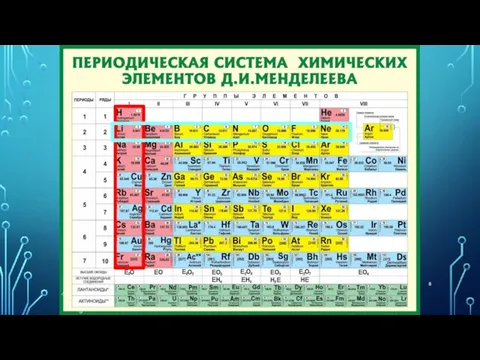
- 14. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Запомнить!!! Номер периода = число энергетических уровней атома. Номер группы = число
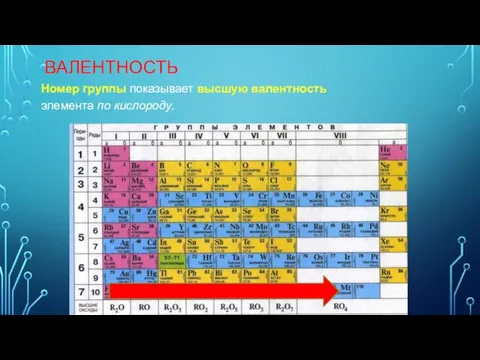
- 15. ВАЛЕНТНОСТЬ Номер группы показывает высшую валентность элемента по кислороду.
- 16. ВАЛЕНТНОСТЬ Элементы IV, V, VI и VII групп образуют летучие водородные соединения. Номер группы показывает валентность
- 18. ЗАДАНИЕ: Назовите в каком периоде и в какой группе, подгруппе находятся следующие химические элементы: Натрий, Медь,
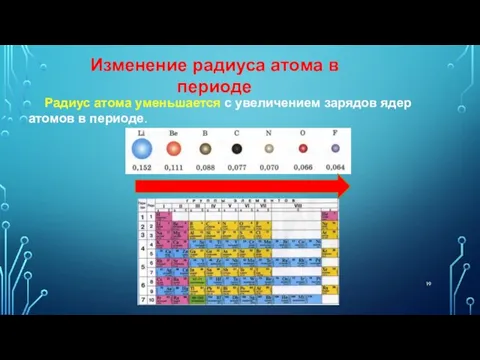
- 19. Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. Изменение радиуса атома в периоде
- 20. В одной группе с увеличением номера периода атомные радиусы возрастают. Изменение радиуса атома в периоде
- 21. ИЗМЕНЕНИЕ РАДИУСОВ АТОМОВ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
- 22. ЗАДАНИЕ: Сравните радиусы следующих химических элементов: Литий, натрий, калий Бор, углерод, азот Кислород, Сера, селен Йод,
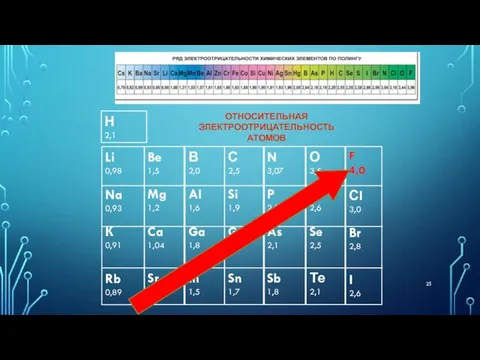
- 23. Электроотрицательность - это способность атома притягивать электронную плотность. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра
- 24. Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх). Самым электроотрицательным элементом является
- 25. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 26. ЗАДАНИЕ: Сравните ЭО следующих химических элементов: Натрий и кислород Углерод и водород Кислород и фтор Бор
- 27. Восстановительные свойства атомов - способность терять электроны при образовании химической связи. Окислительные свойства атомов -способность принимать
- 28. В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают,
- 29. Изменение свойств химических элементов электроотрицательность Окислительные и неметаллические свойства Окислительные и неметаллические свойства
- 30. МЕТАЛЛОИДЫ Ge Sb Po B По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости
- 32. Скачать презентацию






















 Алканы. Циклоалканы
Алканы. Циклоалканы Стелс-материалы
Стелс-материалы Мыс айналымы
Мыс айналымы Биосинтез инвертазы при ферментации гидролизата помола зерна ржи штаммом Aspergillus niger Л-4
Биосинтез инвертазы при ферментации гидролизата помола зерна ржи штаммом Aspergillus niger Л-4 Теоретические основы неорганического синтеза
Теоретические основы неорганического синтеза Chemical bonds
Chemical bonds Ферменты 3. Медицинская энзимология. (Лекция 3)
Ферменты 3. Медицинская энзимология. (Лекция 3) Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Сульфиты. Сульфаты. Кислотные дожди
Сульфиты. Сульфаты. Кислотные дожди Презентация по Химии "Этот многоликий Кальцит" - скачать смотреть
Презентация по Химии "Этот многоликий Кальцит" - скачать смотреть  Металлы побочных подгрупп. Марганец. Хром. (Лекция 15)
Металлы побочных подгрупп. Марганец. Хром. (Лекция 15) Редкие химические элементы
Редкие химические элементы Анаболические стероиды
Анаболические стероиды Физико-химические методы исследования биополимеров: Структурная формула соединения
Физико-химические методы исследования биополимеров: Структурная формула соединения Спекание порошковых систем
Спекание порошковых систем Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева ПРЕЗЕНТАЦИЯ по биологии на тему: «Гормоны и механизм их реализации» Подготовил: ученик лицея №1580 класса 11-4А Попов Алексей Уч
ПРЕЗЕНТАЦИЯ по биологии на тему: «Гормоны и механизм их реализации» Подготовил: ученик лицея №1580 класса 11-4А Попов Алексей Уч КРИСТАЛЛЫ Проект выполнил: Худин Вячеслав ученик 2 «В» класса МОУ «Лицей № 26» Московской области Г. Подольска
КРИСТАЛЛЫ Проект выполнил: Худин Вячеслав ученик 2 «В» класса МОУ «Лицей № 26» Московской области Г. Подольска Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Презентация по Химии "Краткий очерк истории развития химии." - скачать смотреть бесплатно
Презентация по Химии "Краткий очерк истории развития химии." - скачать смотреть бесплатно Презентация по Химии "Колообіг Оксигену, Нітрогену, Карбону в природі" - скачать смотреть бесплатно
Презентация по Химии "Колообіг Оксигену, Нітрогену, Карбону в природі" - скачать смотреть бесплатно Предельные углеводороды
Предельные углеводороды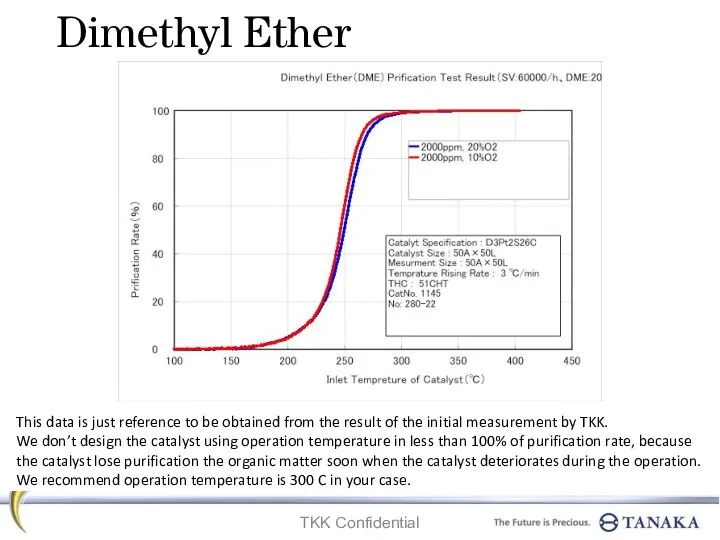 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Основные законы химии
Основные законы химии Правила безпечного використання засобів побутової хімії.
Правила безпечного використання засобів побутової хімії.  Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації
Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Расчет необходимого объема удобрения для внесения
Расчет необходимого объема удобрения для внесения