Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева
Содержание
- 2. Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева. ТБ 02.09.2017
- 3. Химический элемент Химический элемент – это атомы одного вида (одинаковые атомы) Атомы углерода Атомы алюминия
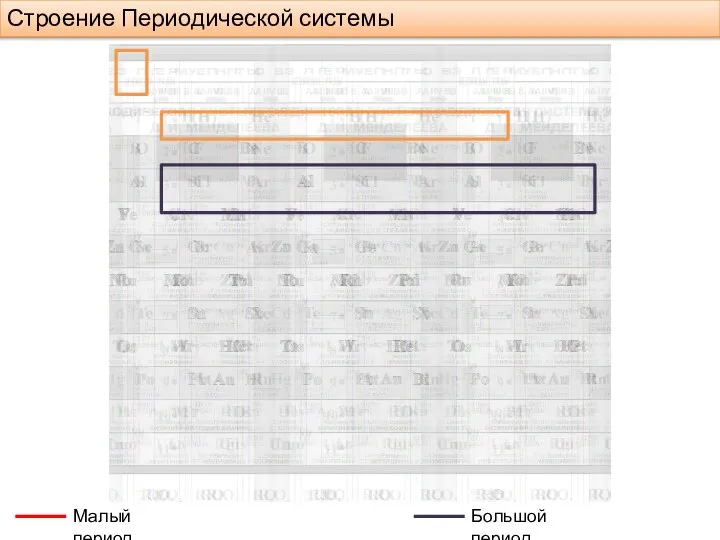
- 4. Строение Периодической системы Малый период Большой период
- 5. Строение Периодической системы
- 6. План характеристика химического элемента 1. Положение элемента в ПС и строение атома Положение в ПС: Са
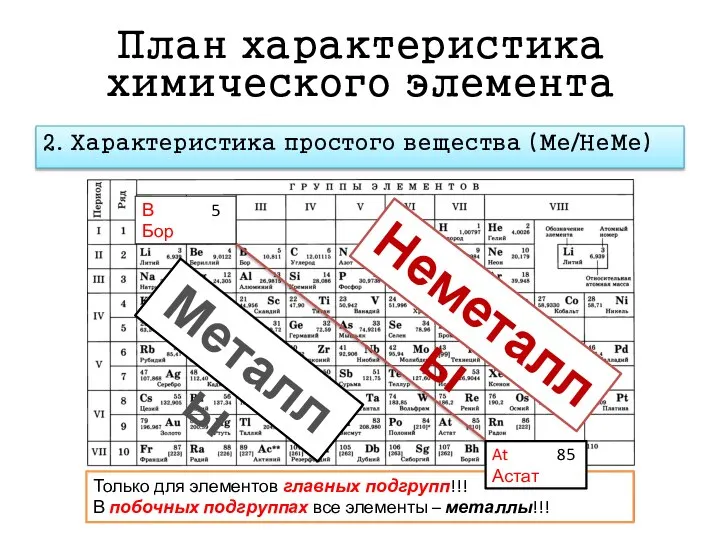
- 7. План характеристика химического элемента 2. Характеристика простого вещества (Ме/НеМе) Металлы Неметаллы Только для элементов главных подгрупп!!!
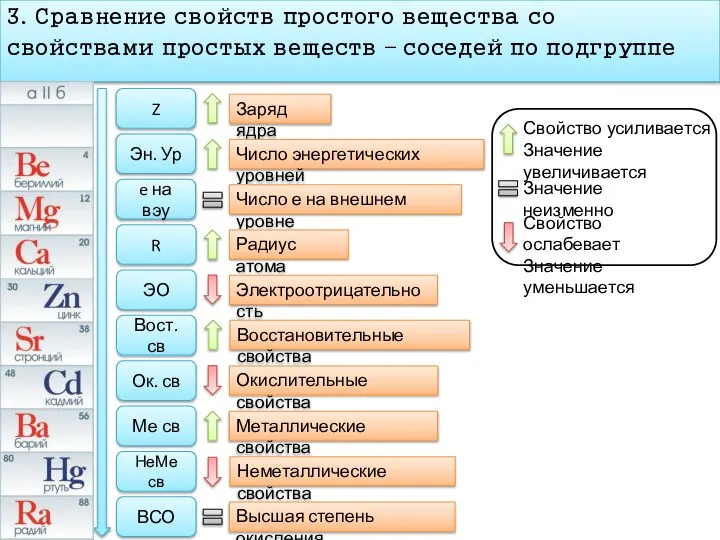
- 8. План характеристика химического элемента 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по
- 9. 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по подгруппе Z Эн. Ур
- 10. 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по подгруппе Z Эн. Ур
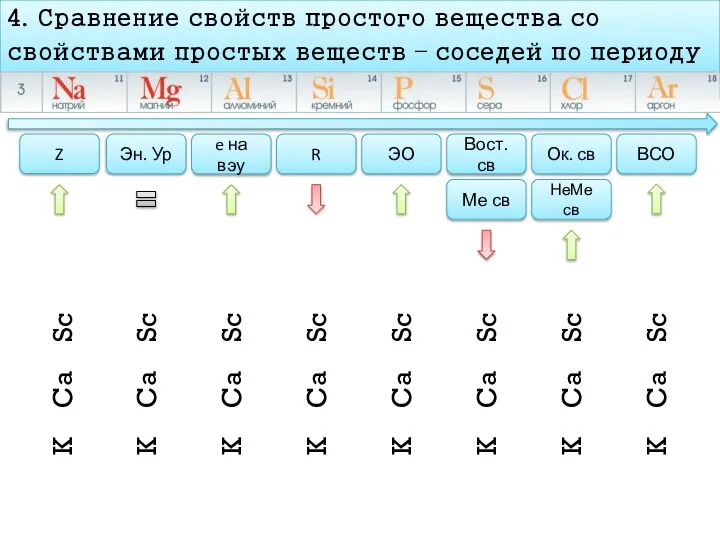
- 11. План характеристика химического элемента 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по
- 12. 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по периоду Z Эн. Ур
- 13. 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по периоду Z Эн. Ур
- 14. План характеристика химического элемента 5. Состав высшего оксида, его характер (основный, кислотный, амфотерный)
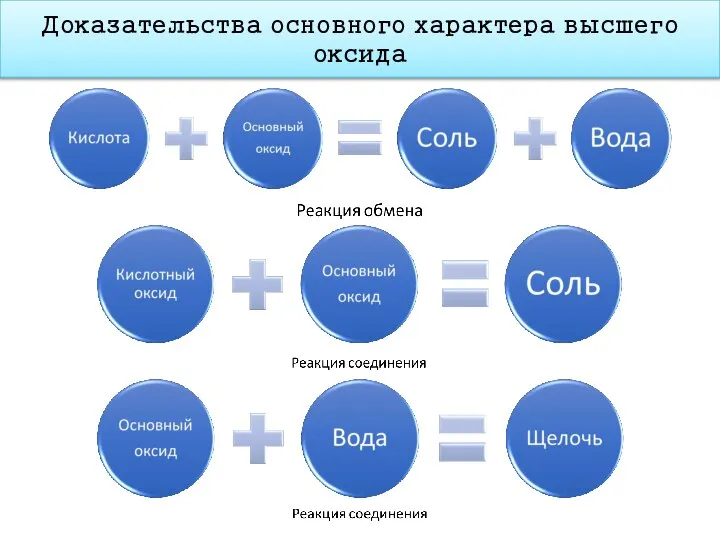
- 15. Доказательства основного характера высшего оксида
- 16. Доказательства кислотного характера высшего оксида
- 17. 6. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид) План характеристика химического элемента Гидроксид
- 18. Доказательства, что гидроксид - основание
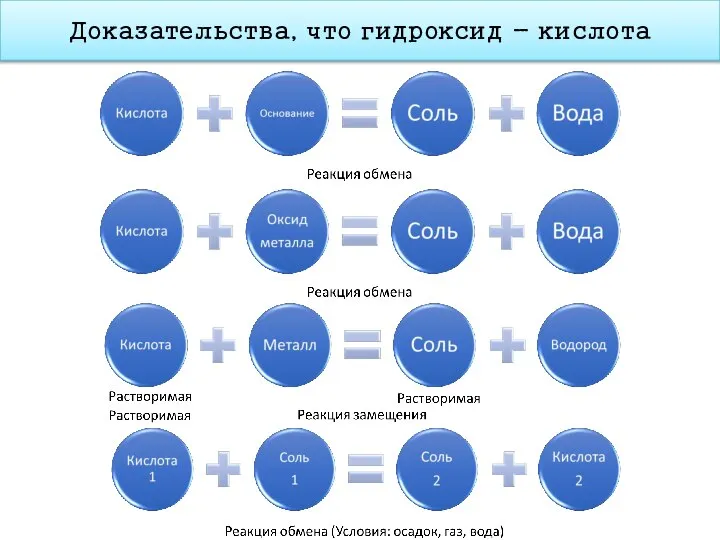
- 19. Доказательства, что гидроксид - кислота
- 20. План характеристика химического элемента 7. Состав летучего водородного соединения (НеМе)
- 25. Скачать презентацию
















 Электролиз воды
Электролиз воды Классификация электродов. (Лекция 4)
Классификация электродов. (Лекция 4) Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды ГИДРОЛИЗ СОЛЕЙ 9 класс
ГИДРОЛИЗ СОЛЕЙ 9 класс  Свойство металлов и сплавов
Свойство металлов и сплавов Задания на ЕГЭ
Задания на ЕГЭ Презентация по химии Угарный газ
Презентация по химии Угарный газ  Изучение химической природы кислорода, углекислого газа и гемоглобина
Изучение химической природы кислорода, углекислого газа и гемоглобина Дифузія у побуті
Дифузія у побуті Алканы
Алканы Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Направление окислительно-восстановительного процесса
Направление окислительно-восстановительного процесса Каучук и резиновые материалы
Каучук и резиновые материалы Строение атома
Строение атома Презентация по Химии "Химия – наука о веществах" - скачать смотреть
Презентация по Химии "Химия – наука о веществах" - скачать смотреть  Каучук, резина, латекс
Каучук, резина, латекс Технология производства хлорбензола
Технология производства хлорбензола Презентация Окислительно-восстановительные реакции
Презентация Окислительно-восстановительные реакции Алкалоиды ряда пирролидина, тропана, хинолина, хинукледина. (Лекция 11)
Алкалоиды ряда пирролидина, тропана, хинолина, хинукледина. (Лекция 11) Презентация Коллоидная химия
Презентация Коллоидная химия  Нуклеїнові кислоти
Нуклеїнові кислоти Пестицидтердің жіктелуі
Пестицидтердің жіктелуі Волокнистые наполнители. (Тема 5)
Волокнистые наполнители. (Тема 5) Урок химии на тему: «Типы химических реакций»
Урок химии на тему: «Типы химических реакций»  EdExcel Unit C2 – Discovering Chemistry
EdExcel Unit C2 – Discovering Chemistry Рубидий, цезий, франций
Рубидий, цезий, франций Общая и неорганическая химия
Общая и неорганическая химия Химическая посуда
Химическая посуда