Содержание
- 3. Закон 1.: Закон сохранения массы. Масса веществ вступивших в реакцию равна массе конечного продукта в изолированной
- 4. Закон 2.: Закон постоянства состава. Вещество независимо от условий получения и места, где оно получено, имеет
- 5. Закон 3.: Закон кратных отношений. Если элементы образуют друг с другом несколько химических соединений, то их
- 6. Закон 4.: Закон эквивалентности. Вещества реагирующие друг с другом в количествах пропорциональных их эквиваленту.
- 7. Простые и сложные Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят
- 9. Эквивалент Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или
- 11. Скачать презентацию








 Лекция № 18 Тема: Равновесия комплексообразования и их роль в аналитической химии
Лекция № 18 Тема: Равновесия комплексообразования и их роль в аналитической химии Электрохимические методы. Потенциометрический анализ объектов окружающей среды
Электрохимические методы. Потенциометрический анализ объектов окружающей среды Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть
Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть  Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Иммунохимические методы. Иммуноферментный анализ (ИФА )
Иммунохимические методы. Иммуноферментный анализ (ИФА ) ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН
ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН  Основы промышленной экологии. Занятие 2
Основы промышленной экологии. Занятие 2 Переосаждение. (Глава 4. § 20. Задача 12)
Переосаждение. (Глава 4. § 20. Задача 12)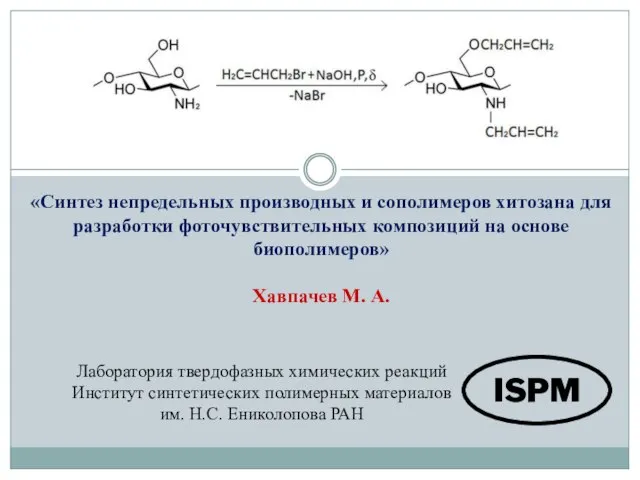 Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Органическая химия
Органическая химия Woda jako rozpuszczalnik
Woda jako rozpuszczalnik Интересные факты о нефти
Интересные факты о нефти Пантотен қышқылы (В3 дәрумені)
Пантотен қышқылы (В3 дәрумені) Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас
Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас Амины
Амины Качество питьевой воды
Качество питьевой воды Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 Производство низших олефинов
Производство низших олефинов Введение в экологическую токсикологию
Введение в экологическую токсикологию «Химия в искусстве»
«Химия в искусстве»  Гранулометрический метод контроля
Гранулометрический метод контроля Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей
Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Презентация по Химии "Интересные факты из Д. И. Менделеева" - скачать смотреть
Презентация по Химии "Интересные факты из Д. И. Менделеева" - скачать смотреть  Типы химических реакций в органической химии
Типы химических реакций в органической химии