Содержание
- 2. Этиле́н — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях —
- 3. Химические свойства: Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит
- 4. Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов: CH2 = CH2 +
- 5. При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по
- 6. Физические свойства: Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо
- 7. Получение Основные способы получения этилена: — дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей CH3-CH2-Br +
- 8. Применение в быту и на производстве Этилен является одним из важнейших соединений, производимых в огромных промышленных
- 10. Скачать презентацию







 Химический элемент побочной подгруппы 1 группы – Cu (Медь) Работу выполнили: ученики 11 класса Арабосинской СОШ Иванов Константин
Химический элемент побочной подгруппы 1 группы – Cu (Медь) Работу выполнили: ученики 11 класса Арабосинской СОШ Иванов Константин  Галогены. Соединения галогенов
Галогены. Соединения галогенов Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі
Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі Броматометрия. (Лекция 10)
Броматометрия. (Лекция 10)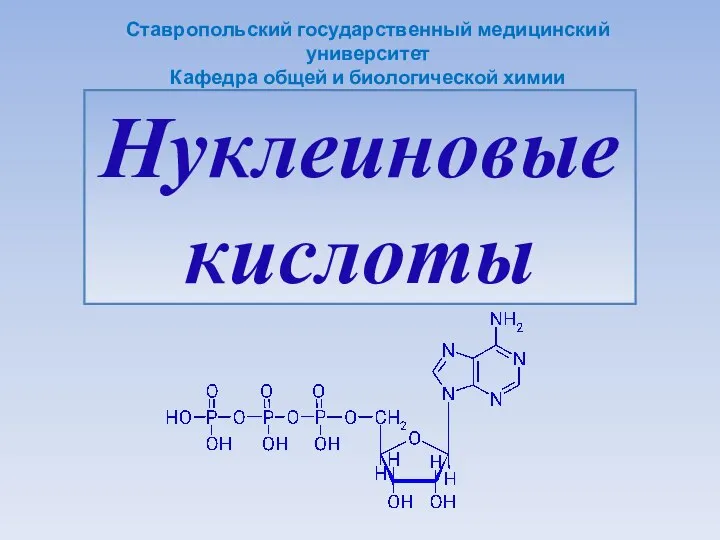 Нуклеиновые кислоты
Нуклеиновые кислоты Приборы для измерения температуры
Приборы для измерения температуры Химия в косметике
Химия в косметике Місце хімії серед наук про природу Підготувала учениця 19-Ф класу Семененко Анна
Місце хімії серед наук про природу Підготувала учениця 19-Ф класу Семененко Анна  Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Природные источники углеводородов
Природные источники углеводородов ОГЭ - 1. Экспериментальная» часть
ОГЭ - 1. Экспериментальная» часть Клетчатка. Алу жолдары
Клетчатка. Алу жолдары Бытовая химия
Бытовая химия Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Вода. Химические и физические свойства воды
Вода. Химические и физические свойства воды Низшие олефины. Методы производства. Направления использования
Низшие олефины. Методы производства. Направления использования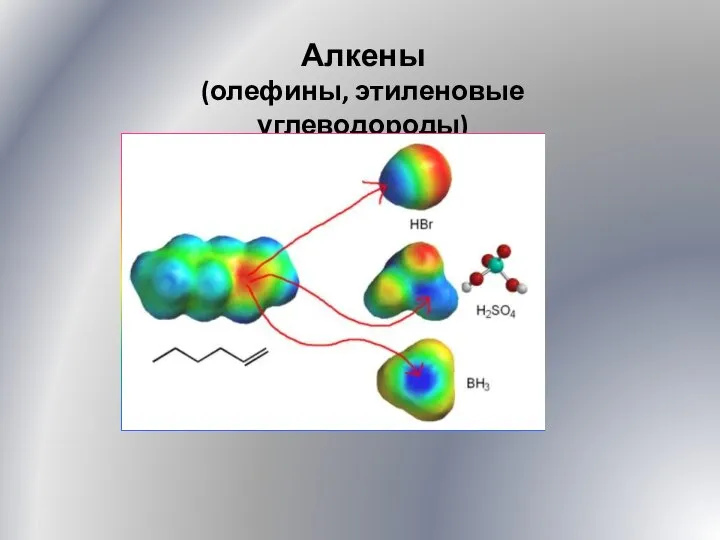 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла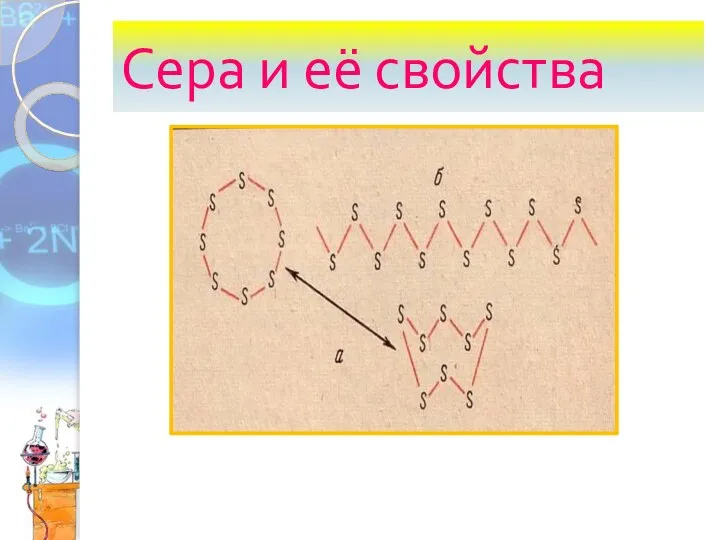 Сера и её свойства
Сера и её свойства Құрамында галогендер бар мономерлер. Винилхлорид пен винилфторидті алу жолдары. Поливинилхлоридты өндіру
Құрамында галогендер бар мономерлер. Винилхлорид пен винилфторидті алу жолдары. Поливинилхлоридты өндіру Алмаз
Алмаз Презентация по Химии "Пить или не пить газированные напитки?" - скачать смотреть
Презентация по Химии "Пить или не пить газированные напитки?" - скачать смотреть 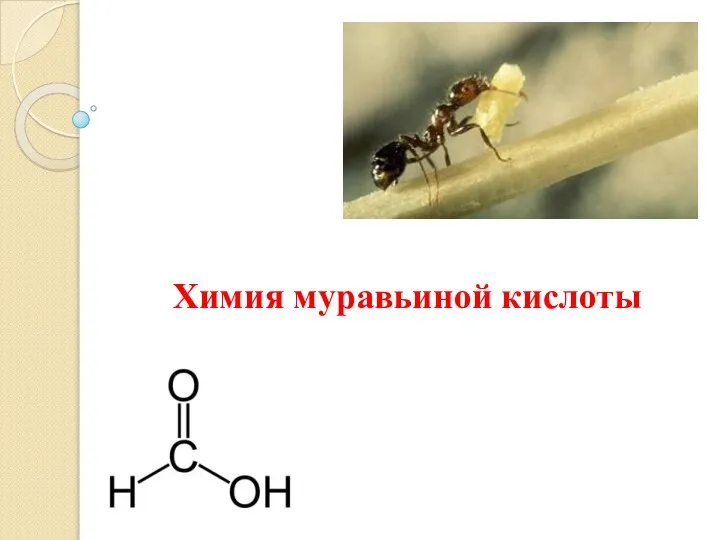 Химия муравьиной кислоты
Химия муравьиной кислоты Phosphorus
Phosphorus Метанол, етанол, гліцерин, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.
Метанол, етанол, гліцерин, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.  Cellulase. Introduction (source)
Cellulase. Introduction (source) Комплексные соединения
Комплексные соединения