Содержание
- 2. ОСНОВНЫЕ ЭТАПЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА (АМИНОКИСЛОТНЫЙ АНАЛИЗ) ОПРЕДЕЛЕНИЕ N-
- 3. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ МАСС-СПЕКТРОМЕТРИЯ ЭЛЕКТРОФОРЕЗ 3. ГЕЛЬ-ФИЛЬТРАЦИЯ 4. УЛЬТРАЦЕНТРИФУГИРОВАНИЕ
- 4. Принцип аминокислотного анализа Гидролиз в 5,7н HCl при 1100C в вакууме в течение 24-96 часов
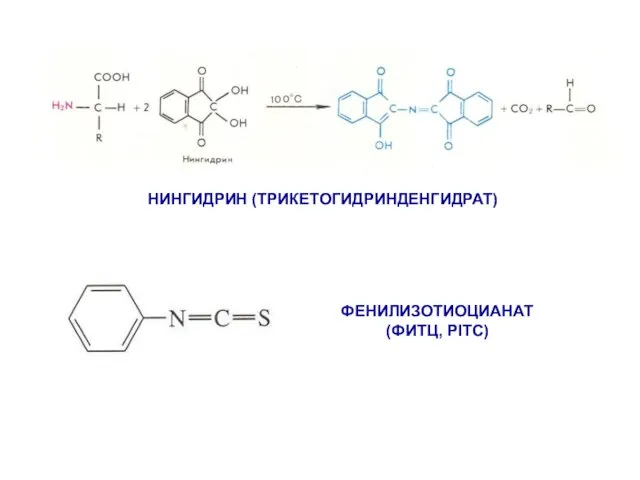
- 5. ФЕНИЛИЗОТИОЦИАНАТ (ФИТЦ, PITC) НИНГИДРИН (ТРИКЕТОГИДРИНДЕНГИДРАТ)
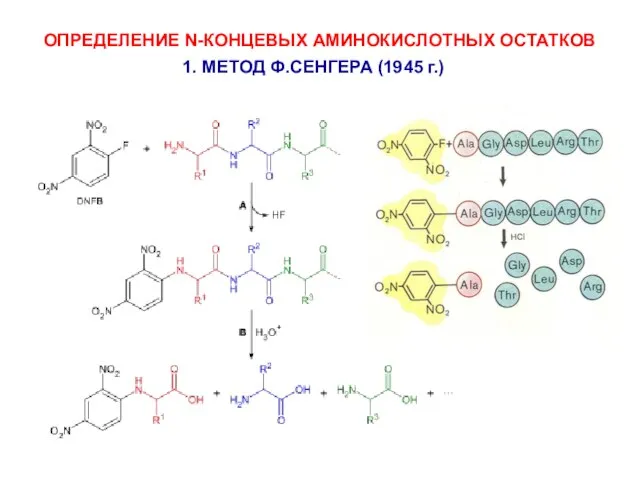
- 6. ОПРЕДЕЛЕНИЕ N-КОНЦЕВЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ 1. МЕТОД Ф.СЕНГЕРА (1945 г.)
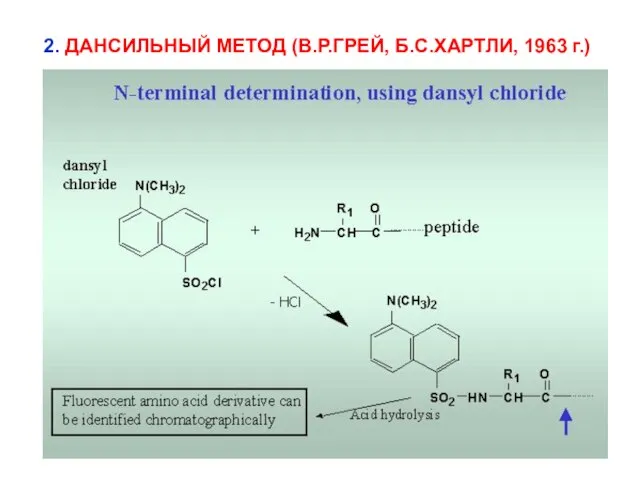
- 7. 2. ДАНСИЛЬНЫЙ МЕТОД (В.Р.ГРЕЙ, Б.С.ХАРТЛИ, 1963 г.)
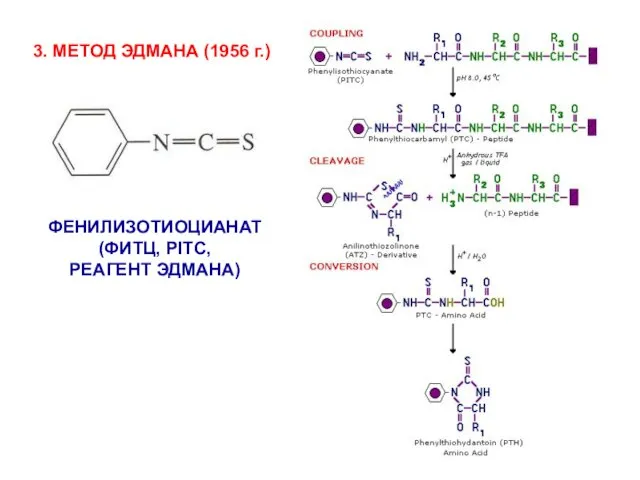
- 8. 3. МЕТОД ЭДМАНА (1956 г.) ФЕНИЛИЗОТИОЦИАНАТ (ФИТЦ, PITC, РЕАГЕНТ ЭДМАНА)
- 9. 4. ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ АМИНОПЕПТИДАЗАМИ ЛЕЙЦИНАМИНОПЕПТИДАЗА (С НАИБОЛЬШЕЙ СКОРОСТЬЮ ГИДРОЛИЗУЕТ СВЯЗИ Leu, Ile, Val) АМИНОПЕПТИДАЗА М (ГИДРОЛИЗУЕТ
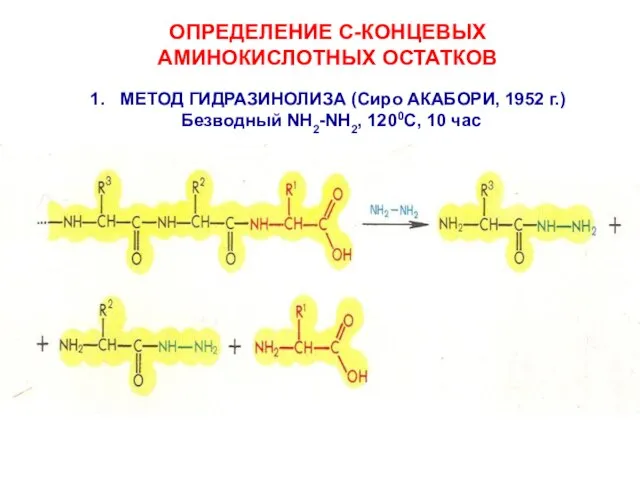
- 10. ОПРЕДЕЛЕНИЕ С-КОНЦЕВЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ МЕТОД ГИДРАЗИНОЛИЗА (Сиро АКАБОРИ, 1952 г.) Безводный NH2-NH2, 1200C, 10 час
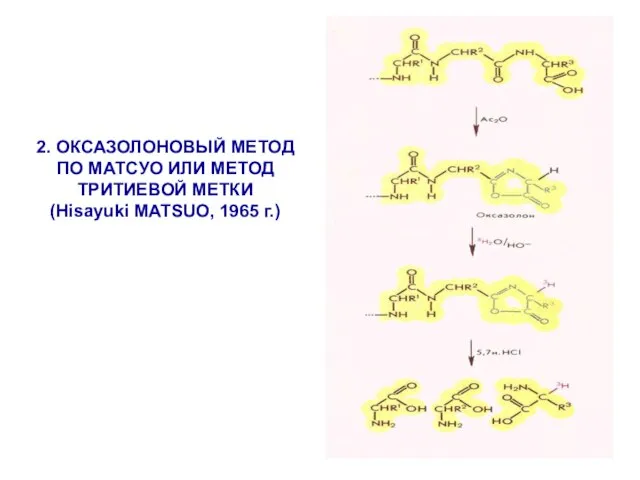
- 11. 2. ОКСАЗОЛОНОВЫЙ МЕТОД ПО МАТСУО ИЛИ МЕТОД ТРИТИЕВОЙ МЕТКИ (Hisayuki MATSUO, 1965 г.)
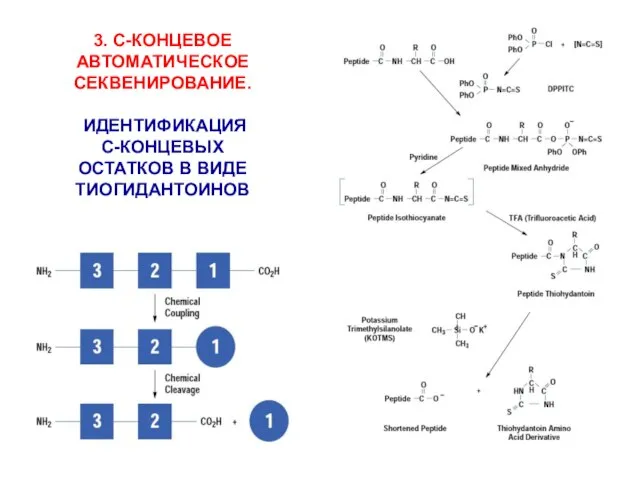
- 12. 3. С-КОНЦЕВОЕ АВТОМАТИЧЕСКОЕ СЕКВЕНИРОВАНИЕ. ИДЕНТИФИКАЦИЯ С-КОНЦЕВЫХ ОСТАТКОВ В ВИДЕ ТИОГИДАНТОИНОВ
- 13. 4. ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ КАРБОКСИПЕПТИДАЗАМИ
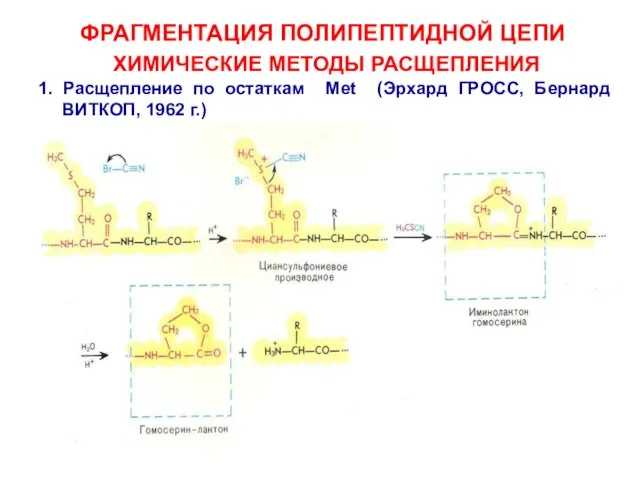
- 14. ФРАГМЕНТАЦИЯ ПОЛИПЕПТИДНОЙ ЦЕПИ ХИМИЧЕСКИЕ МЕТОДЫ РАСЩЕПЛЕНИЯ 1. Расщепление по остаткам Met (Эрхард ГРОСС, Бернард ВИТКОП, 1962
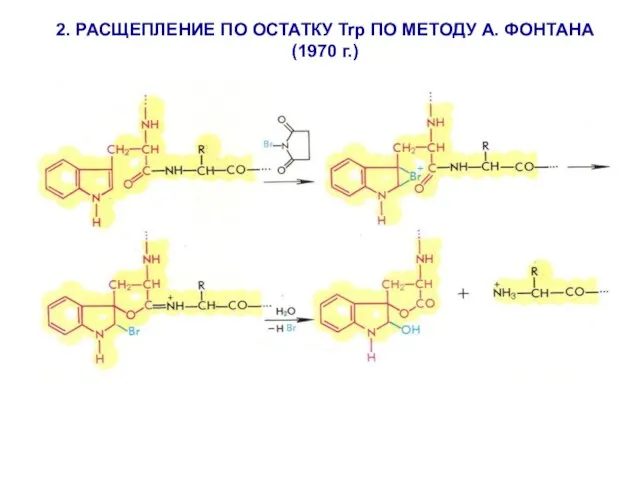
- 15. 2. РАСЩЕПЛЕНИЕ ПО ОСТАТКУ Trp ПО МЕТОДУ А. ФОНТАНА (1970 г.)
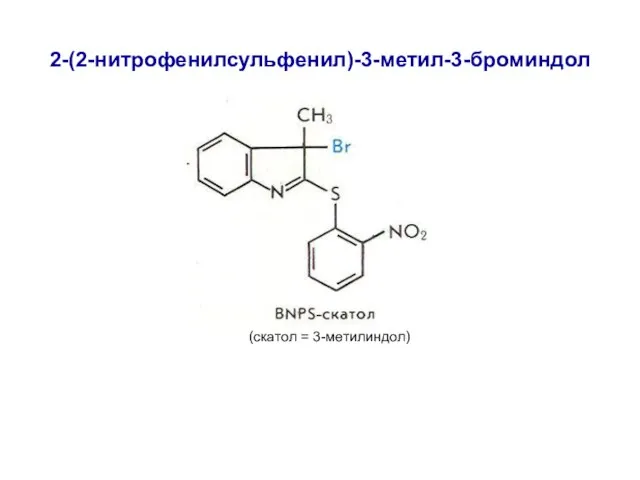
- 16. 2-(2-нитрофенилсульфенил)-3-метил-3-броминдол (скатол = 3-метилиндол)
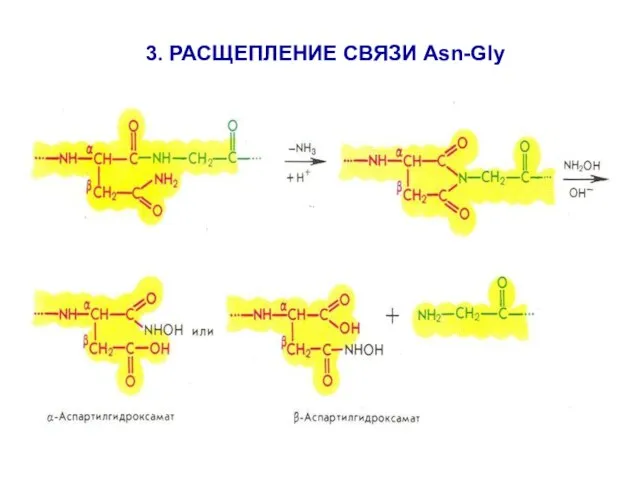
- 17. 3. РАСЩЕПЛЕНИЕ СВЯЗИ Asn-Gly
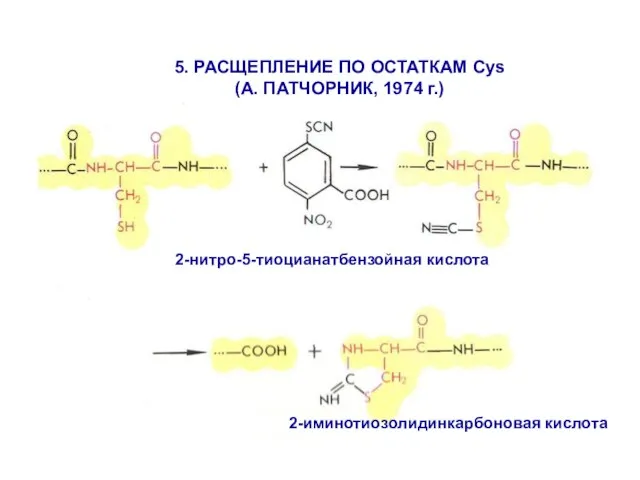
- 18. 2-иминотиозолидинкарбоновая кислота 5. РАСЩЕПЛЕНИЕ ПО ОСТАТКАМ Cys (А. ПАТЧОРНИК, 1974 г.) 2-нитро-5-тиоцианатбензойная кислота
- 19. ФЕРМЕНТАТИВНЫЕ МЕТОДЫ ФРАГМЕНТАЦИИ ПОЛИПЕПТИДНОЙ ЦЕПИ ВЫСОКАЯ СПЕЦИФИЧНОСТЬ 1. Трипсин pH 7,0-9,0 Lys—X Arg—X Lys—Pro Arg—Pro Протеаза
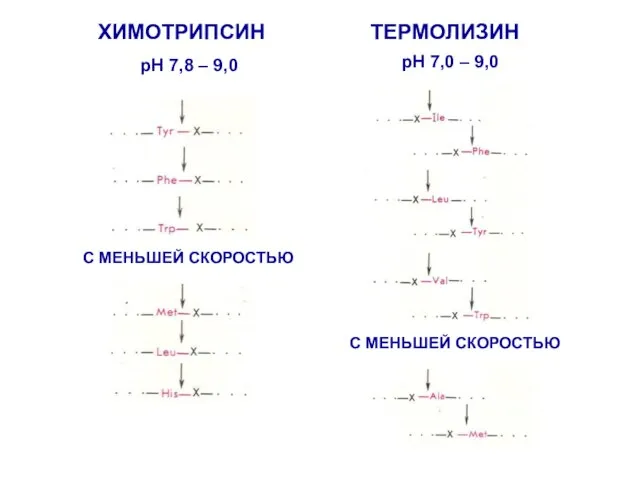
- 20. ХИМОТРИПСИН ТЕРМОЛИЗИН pH 7,8 – 9,0 С МЕНЬШЕЙ СКОРОСТЬЮ pH 7,0 – 9,0 С МЕНЬШЕЙ СКОРОСТЬЮ
- 21. ЛИЗИН-СПЕЦИФИЧЕСКАЯ ПРОТЕАЗА ИЗ Armillaria mellea pH 8,0 ЭНДОПРОТЕИНАЗА Lys-C ИЗ Lysobacter ensymogenes КЛОСТРИПАИН ИЗ Clostridium histolyticum
- 23. Скачать презентацию







 Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Альдегиды и кетоны
Альдегиды и кетоны Презентация по химии Удобрения и их классификация
Презентация по химии Удобрения и их классификация Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов Тайна мыльного пузыря
Тайна мыльного пузыря Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Тема: «Пищевые жиры»
Тема: «Пищевые жиры» 6 классов ферментов и тривиальные названия некоторых основных групп
6 классов ферментов и тривиальные названия некоторых основных групп Виды химической связи
Виды химической связи Строение электронной оболочки атома
Строение электронной оболочки атома Пурины. Строение пурина. (Лекция 9)
Пурины. Строение пурина. (Лекция 9) Гомологи аренов
Гомологи аренов Люминесцентный анализ
Люминесцентный анализ Идеальный и реальный газ
Идеальный и реальный газ Отчет о проделанной работе. Химик-аналитик АЛ ИЦ Малько А.В
Отчет о проделанной работе. Химик-аналитик АЛ ИЦ Малько А.В Iodine. Physical properties. Application of iodine
Iodine. Physical properties. Application of iodine Роль Химии в жизни общества
Роль Химии в жизни общества Кислородные соединения азота
Кислородные соединения азота Химический элемент сера
Химический элемент сера Основные сведения о строении атома
Основные сведения о строении атома Кремний – бог неорганической природы
Кремний – бог неорганической природы Дисперсные системы
Дисперсные системы Презентация по химии Основные классы неорганических соединений
Презентация по химии Основные классы неорганических соединений  Органическая химия. История развития
Органическая химия. История развития Полімери
Полімери  Полимеры. Функции полимеров
Полимеры. Функции полимеров Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych