Содержание
- 2. Некоторые несложные химические опыты можно проводить в домашних условиях с использованием веществ, которые можно найти на
- 3. Есть такие химические опыты, вещества для которых не всегда могут оказаться дома. Для проведения опытов можно
- 4. Цель нашей работы: получить кристаллы и попытаться объяснить происходящие явления. Объект исследования: безопасные и простые опыты
- 5. Задачи исследования: Изучить технику безопасности при проведении опытов по химии в домашних условиях. Провести опыт «Белые
- 6. «Химический» анекдот -Почему ты так поздно пришел из школы? -Мы ставили химический эксперимент. -Неужели он так
- 7. ТЕХНИКА БЕЗОПАСНОСТИ При проведении химических опытов нужно соблюдать технику безопасности: ! Не проводи опытов с нагреванием
- 8. Опыт «Белые иглы» 1. Этап: подготовка к опыту.
- 9. Опыт «Белые иглы» Приборы и реактивы: Поваренная соль (NaCl) сульфат меди (CuSO4) сульфит натрия (Na2SO3) вода(H2O),
- 10. Что нужно делать? Насыпать в пробирку на 1 см по высоте соль (NaCl), Добавить немного воды,
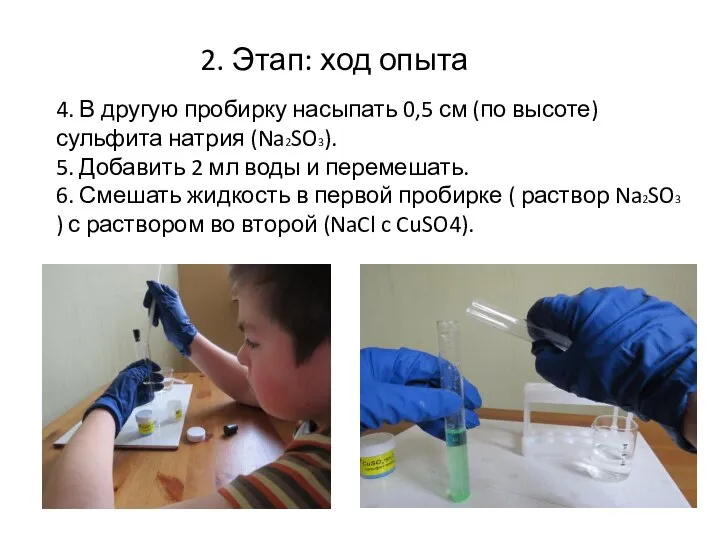
- 11. 4. В другую пробирку насыпать 0,5 см (по высоте) сульфита натрия (Na2SO3). 5. Добавить 2 мл
- 12. Наблюдения: выпадает светло-желтый осадок, который через некоторое время превращается в белый. Можно увидеть кристаллы. 2. Этап:
- 13. Почему так получилось? Сульфит меди (CuSO3) – соединение неустойчивое и в присутствии хлоридов превращается в хлорид
- 14. При стоянии на влажном воздухе иглы хлорида меди I (CuCl) реагируют с кислородом и медленно зеленеют:
- 15. Изучение ХИМИИ можно начинать в ЛЮБОМ ВОЗРАСТЕ, с простых и интересных ОПЫТОВ. Выводы: При проведении опытов
- 17. Скачать презентацию













 Кислоты в свете ТЭД их классификация и свойства
Кислоты в свете ТЭД их классификация и свойства Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Неметаллы: общая характеристика
Неметаллы: общая характеристика Процесс электролиза
Процесс электролиза Ситалл – искусственный поликристаллический материал
Ситалл – искусственный поликристаллический материал Кристаллические решетки Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014
Кристаллические решетки Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014 Карбо́новые кисло́ты
Карбо́новые кисло́ты Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Катализ.Лекция
Катализ.Лекция Исследование химического состава шоколада и способов его приготовления
Исследование химического состава шоколада и способов его приготовления Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Физические свойства металлов. Сплавы
Физические свойства металлов. Сплавы Презентация по Химии "«Аминокислоты»" - скачать смотреть _
Презентация по Химии "«Аминокислоты»" - скачать смотреть _ Ионная полимеризация. Катионная полимеризация
Ионная полимеризация. Катионная полимеризация Проблемы химической безопасности в России
Проблемы химической безопасности в России Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Дисперсные системы. Дисперсионная среда
Дисперсные системы. Дисперсионная среда Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.
Штучні волокна Підготували учениці 7(11) – А класу Єзерська В., Крамарук М.  Углеводы
Углеводы Презентация по Химии "Ферменты" - скачать смотреть
Презентация по Химии "Ферменты" - скачать смотреть  Ионообменная хроматография
Ионообменная хроматография Нихром. Физические свойства
Нихром. Физические свойства Алкены
Алкены История одного открытия
История одного открытия  Відходи хімічного синтезу: утворення та попередження
Відходи хімічного синтезу: утворення та попередження Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Вибух газо- та пароповітряних сумішей на відкритому просторі та в приміщенні
Вибух газо- та пароповітряних сумішей на відкритому просторі та в приміщенні Автор учитель МОУ СОШ №3 города Волгореченска Звёздочкина С.А.
Автор учитель МОУ СОШ №3 города Волгореченска Звёздочкина С.А.