Содержание
- 2. План 1. Определение предмета орг. химии. 2. Признаки органических веществ. 3. Особенности углерода. 4. Виды ковалентной
- 3. 1. Органическая химия – наука о соединениях углерода, их свойствах, строении и превращениях. 2. Признаки органических
- 4. 3. В учебнике «Основы химии» Д.И.Менделеев писал: «Способность атомов углерода соединяться между собой и давать сложные
- 5. В органических веществах существуют, в основном, ковалентные химические связи: а) А. + .А = А:А б)
- 6. б) Если наибольшая электронная плотность находится под углом к ядрам атомов, такая ковалентная связь называется пи(π)
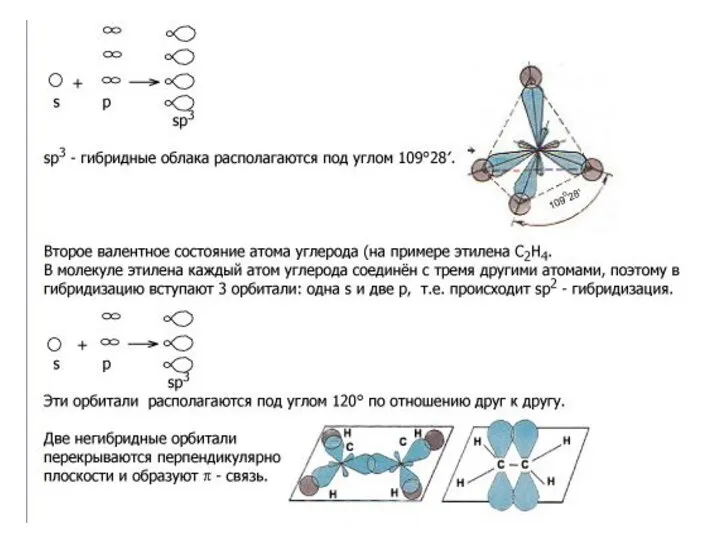
- 7. В образовании сигма (σ)-связи участвуют гибридизованные электронные облака. Гибридизация – это выравнивание электронных облаков по форме,
- 9. Органические соединения делятся на три большие группы: 1. Углеводороды. 2. Кислородсодержащие. 3. Азотсодержащие. Классы углеводородов отличаются
- 10. Кислородсодержащие органические вещества делятся на спирты, простые эфиры, альдегиды, карбоновые кислоты, сложные эфиры, углеводы и т.
- 11. Теория строения органических соединений.
- 12. План урока 1.Письменный опрос: а)В чем заключается виталистическая теория Берцелиуса? Крах вит. теории. б)Перечислить особенности орг.
- 13. 2.Основные положения ТХС. 3.Понятия валентности, гомологии, изомерии. 4.Структурные формулы орг. соединений. Д/З №2, составить формулы двух
- 16. Атомы, соединенные в молекулу, взаимно влияют друг на друга. Наибольшее влияние оказывают атомы, соединенные непосредственно. Структурные
- 17. 1.Валентность – это свойство атомов ХЭ образовывать определенное число химических связей. 2.Вещества, которые имеют одинаковый качественный
- 18. Гомологический ряд метана: СН4, С2Н6, С3Н8, С4Н8 Метан Этан Пропан Бутан Гомологический ряд этилена: С2Н4, С3Н6
- 19. 3.Изомеры – это в – ва, которые имеют одинаковую молекулярную формулу (качественный и количественный состав), но
- 22. Урок №3 Предельные углеводороды (алканы, парафины )
- 23. План 1.Определение алканов. 2.Строение молекулы: а)первое валентное состояние углерода б)пространственное строение молекул в)изомерия и номенклатура алканов
- 24. Предельные УВ (алканы, парафины) - это соединения, в которых химические связи углерода до предела насыщены атомами
- 25. В молекулах алканов существует малополярная (s – p) и неполярная (р – р) сигма – связь.
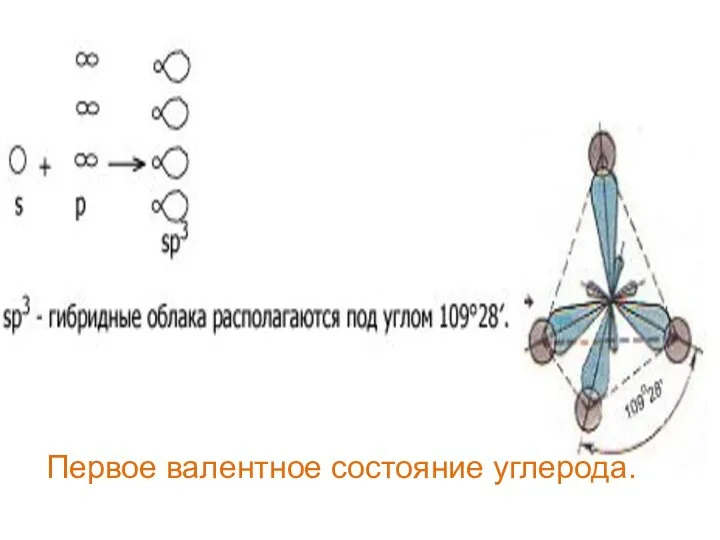
- 26. Первое валентное состояние углерода.
- 27. В алканах атомы углерода находятся в sp3- гибридизации. Это первое валентное состояние атомов углерода. Гибридизованные электронные
- 28. В ряду алканов существует изомерия по разветвлению углеродного скелета. В р – х изомеризации УВ нормального
- 29. Физические свойства алканов Таблица с. 26, учебник.
- 30. Вывод: Изменение физических свойств парафинов подтверждают один из законов диалектики – переход количества в качество. 4.
- 32. Скачать презентацию


























 Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Вакуумное фильтрование
Вакуумное фильтрование Битумы природного происхождения
Битумы природного происхождения Растворение. Растворы
Растворение. Растворы Вещества
Вещества Пропан, C3H8
Пропан, C3H8 Презентация по Химии "Соединения" - скачать смотреть бесплатно
Презентация по Химии "Соединения" - скачать смотреть бесплатно Минералы и Близнецы
Минералы и Близнецы Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Химические реакции (11 класс)
Химические реакции (11 класс) Диазо- и азосоединения
Диазо- и азосоединения Структура кристаллических полимеров
Структура кристаллических полимеров Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Железо. Физические и химические свойства
Железо. Физические и химические свойства Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно
Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К
Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К Методы светорассеяния для исследования растворов (био) полимеров и наночастиц
Методы светорассеяния для исследования растворов (био) полимеров и наночастиц Презентация по Химии "Семь доисторических металлов" - скачать смотреть
Презентация по Химии "Семь доисторических металлов" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Shapes of molecules
Shapes of molecules Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Оксиды азота
Оксиды азота Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Химическая очистка воды
Химическая очистка воды