Содержание
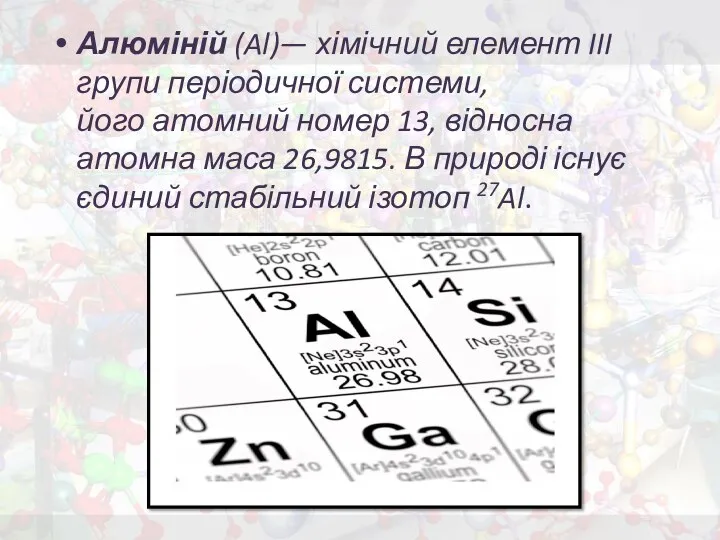
- 2. Алюміній (Al)— хімічний елемент III групи періодичної системи, його атомний номер 13, відносна атомна маса 26,9815.
- 3. Статуя Антероса на площі Піккаділлі в Лондоні, виготовлена в 1893 і є однією з перших статуй
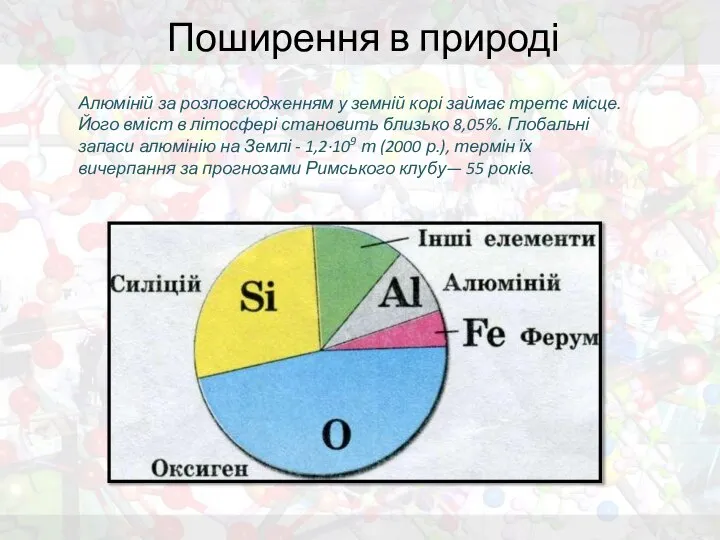
- 4. Поширення в природі Алюміній за розповсюдженням у земній корі займає третє місце. Його вміст в літосфері
- 5. В природі зустрічається винятково у вигляді сполук, входить до складу 270 мінералів. Його найважливішими мінералами є:
- 6. Фізичні властивості Алюмінію сріблясто-білий легкий метал Густина - 2,69872 г/см³ t = 6600C добрий провідник тепла
- 7. Реакції з киснем На повітрі він швидко окиснюється і вкривається тонкою плівкою алюміній оксиду. Оксидна плівка
- 8. Реакції з кислотами Алюміній реагує з розчинами кислот з утворенням солей і водню, наприклад: 2Al +
- 9. Реакції з лугами Оксидна плівка легко розчиняється в лугах і алюміній реагує з розчинами лугів з
- 10. Починаючи з кінця 1930-х років, ведеться пошук нових методів пайки, спеціально призначених для алюмінію та його
- 11. Чистий алюміній застосовується у виробництві фольги, яка широко використовується для виробництва електролітичних конденсаторів і пакувальних матеріалів
- 12. Основна кількість провідникової продукції — голі, обмоткові і ізольовані проводи, кабелі в одно- і багатожилковому виконанні
- 14. Скачать презентацию









 Физическая химия дисперсных систем
Физическая химия дисперсных систем Металлы и сплавы
Металлы и сплавы Бактериалық жасушаның химиялық құрамы
Бактериалық жасушаның химиялық құрамы Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Значение воды. Изучение биологических свойств воды
Значение воды. Изучение биологических свойств воды Этанол (этиловый спирт)
Этанол (этиловый спирт) Атомистическое моделирование
Атомистическое моделирование Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Исследование соединений со структурой слоистого перовскита
Исследование соединений со структурой слоистого перовскита Polymers
Polymers Каменный уголь
Каменный уголь Химическая связь и строение молекул. Лекция 2
Химическая связь и строение молекул. Лекция 2 Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15)
Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15) Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж
Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Энергетика химических превращений. Первый закон термодинамики
Энергетика химических превращений. Первый закон термодинамики Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Аттестацианная работа. Основы исследовательской деятельности по химии
Аттестацианная работа. Основы исследовательской деятельности по химии Хімія та їжа
Хімія та їжа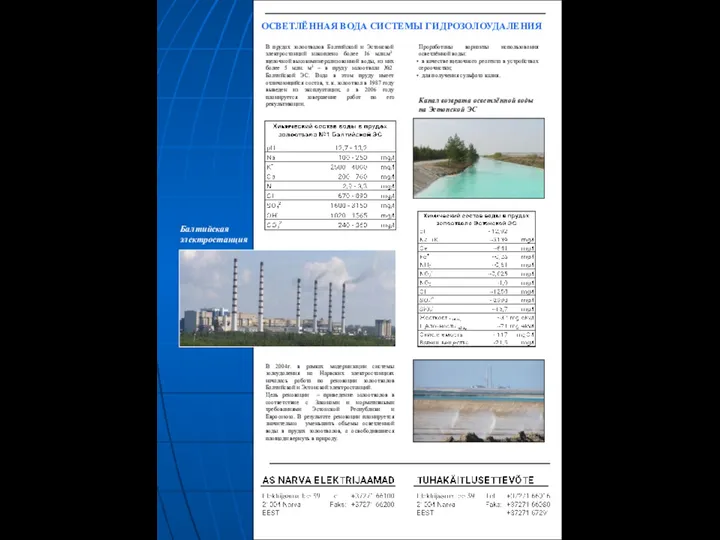 Осветлённая вода системы гидрозолоудаления
Осветлённая вода системы гидрозолоудаления Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Аппарат Киппа
Аппарат Киппа Алюминий и его соединения
Алюминий и его соединения Використання хімічних явищ у художній творчості й народних ремеслах
Використання хімічних явищ у художній творчості й народних ремеслах МИР ИНДИКАТОРОВ
МИР ИНДИКАТОРОВ Биохимия соединительной ткани
Биохимия соединительной ткани