Содержание
- 2. Основная литература
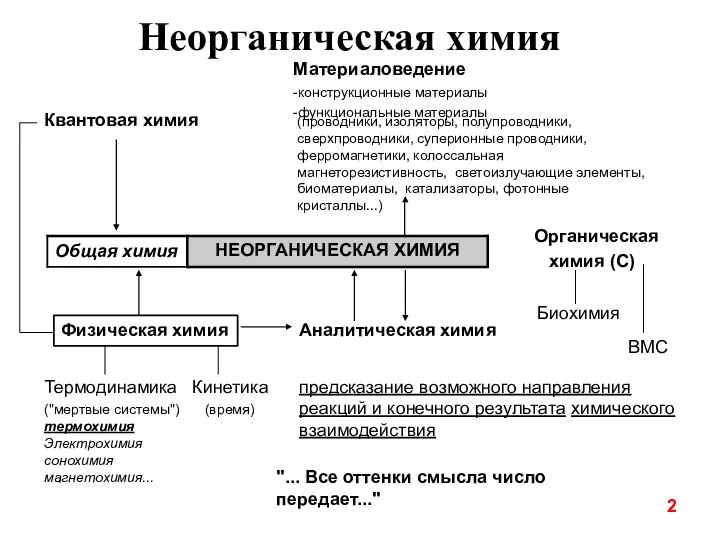
- 3. 2 Неорганическая химия Материаловедение -конструкционные материалы -функциональные материалы (проводники, изоляторы, полупроводники, сверхпроводники, суперионные проводники, ферромагнетики, колоссальная
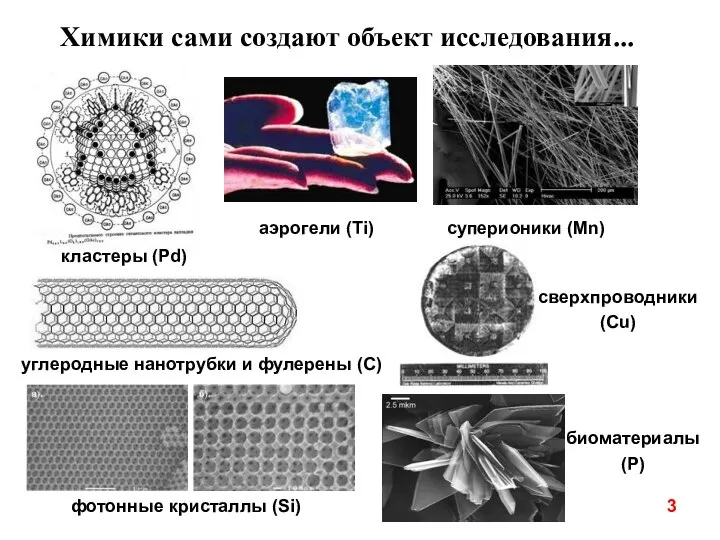
- 4. 3 Химики сами создают объект исследования... кластеры (Pd) углеродные нанотрубки и фулерены (C) фотонные кристаллы (Si)
- 5. Признаки химической реакции -изменение цвета (J2 и крахмал, Fe3+ и роданиды, "лисий хвост", KMnO4) -появление запаха
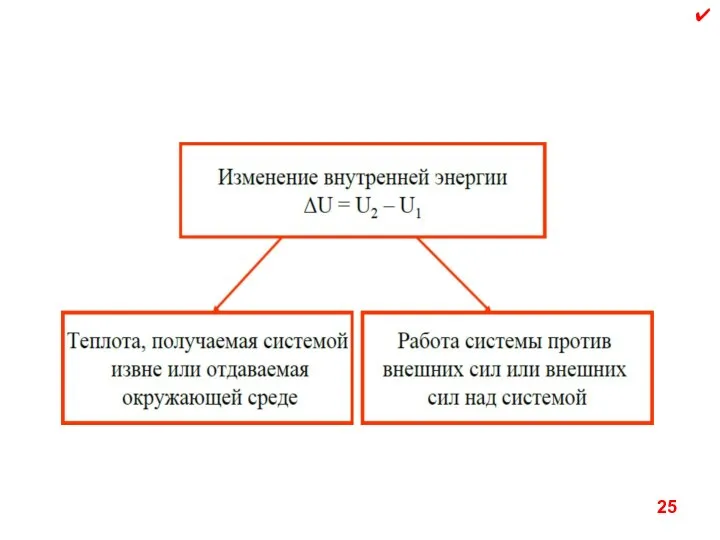
- 6. 5 Система законов закон т.д. → Q, A, U, H, Cp, CV, з-ны Гесса и Кирхгоффа
- 7. ✔
- 8. ✔
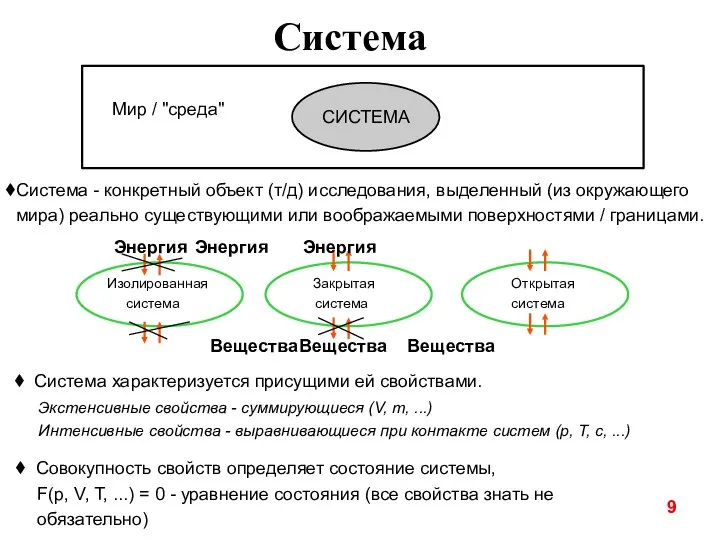
- 9. Система Изолированная система Закрытая система Открытая система Система - конкретный объект (т/д) исследования, выделенный (из окружающего
- 10. Существует и неравновесная динамика, описывающая открытые системы и диссипативные структуры, это совершенно другие подходы в описании
- 11. Свойства (параметры) системы Экстенсивные свойства - суммирующиеся (V, m, ...) Интенсивные свойства - выравнивающиеся при контакте
- 12. ✔
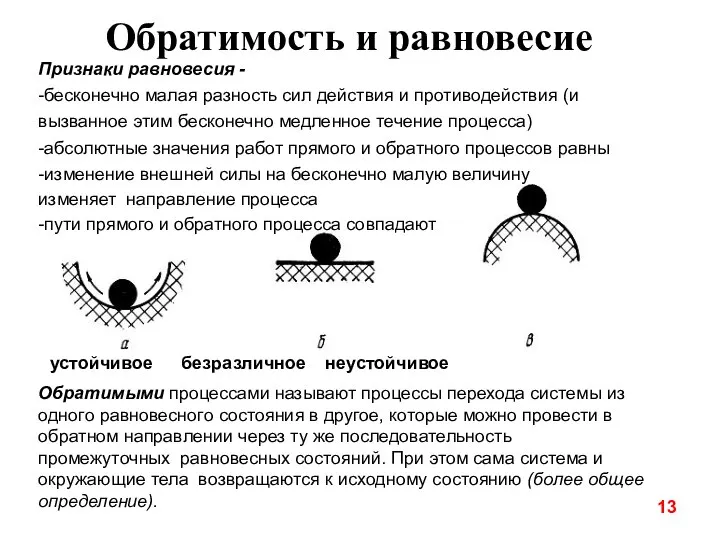
- 13. Обратимость и равновесие Признаки равновесия - -бесконечно малая разность сил действия и противодействия (и вызванное этим
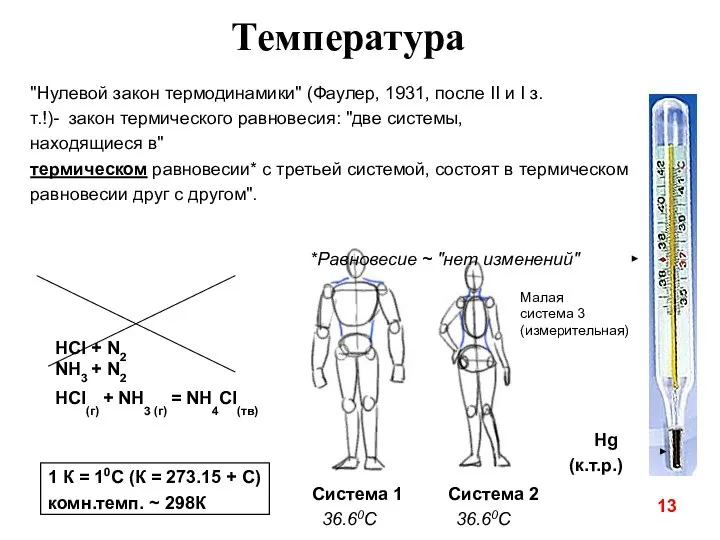
- 14. 13 Температура Hg (к.т.р.) "Нулевой закон термодинамики" (Фаулер, 1931, после II и I з.т.!)- закон термического
- 15. Теплота Температура - мера нагретости ("теплое-холодное") (интенсивный параметр) Передача теплоты - "микрофизический" ("молекулярный") способ передачи энергии
- 16. ✔
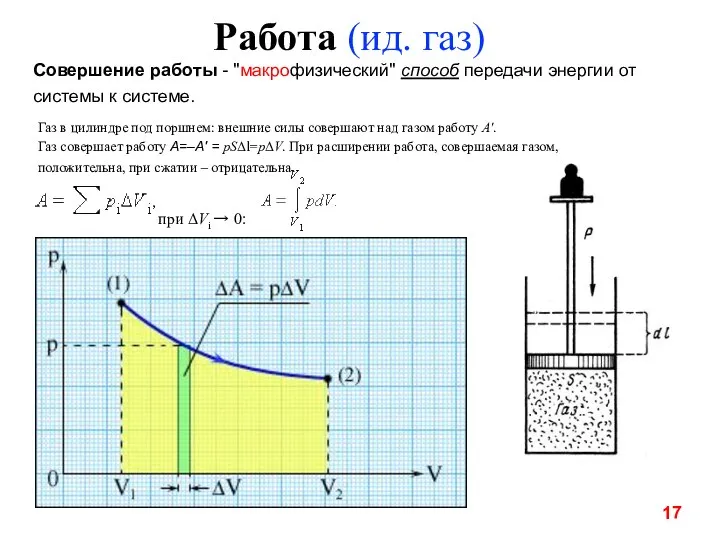
- 17. Работа (ид. газ) Совершение работы - "макрофизический" способ передачи энергии от системы к системе. Газ в
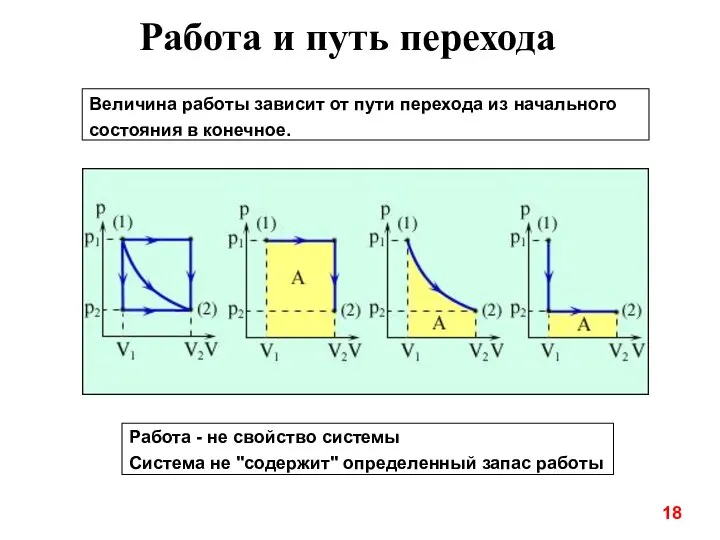
- 18. Работа и путь перехода Величина работы зависит от пути перехода из начального состояния в конечное. Работа
- 19. ✔
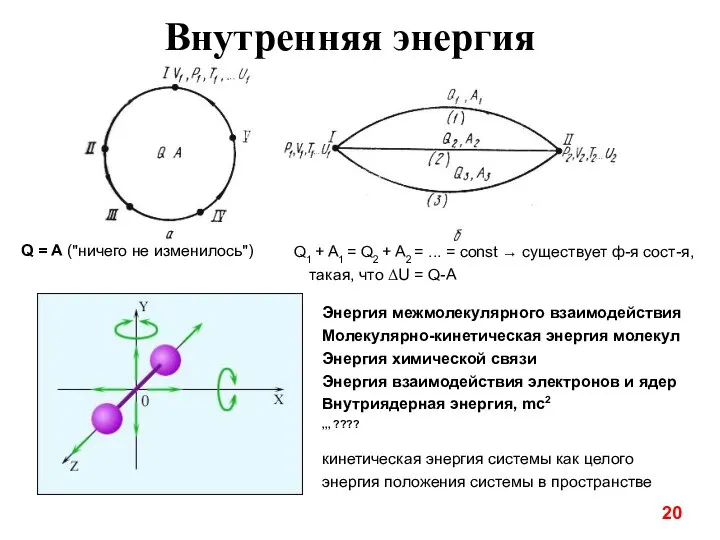
- 20. Внутренняя энергия кинетическая энергия системы как целого энергия положения системы в пространстве Q = A ("ничего
- 21. ✔
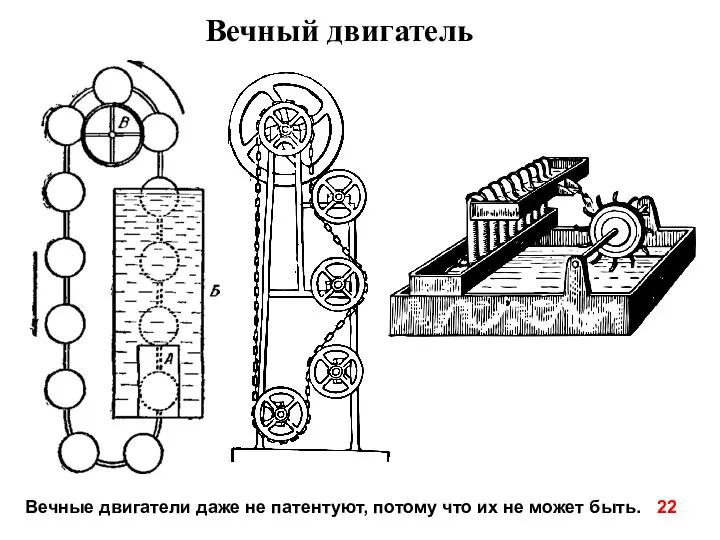
- 22. Вечный двигатель Вечные двигатели даже не патентуют, потому что их не может быть.
- 23. М.В.Ломоносов и закон сохранения HgO = Hg + 1/2 O2
- 24. Первый закон т.д. "Энергия не создается и не уничтожается" (дефект массы, E=mc2) М.В.Ломоносов: «... сколько ...
- 25. ✔
- 26. Предыстория 1 з.т. Механика → Теплород → Энергия → Равновесие, термодинамика Блейк (1759) - различие между
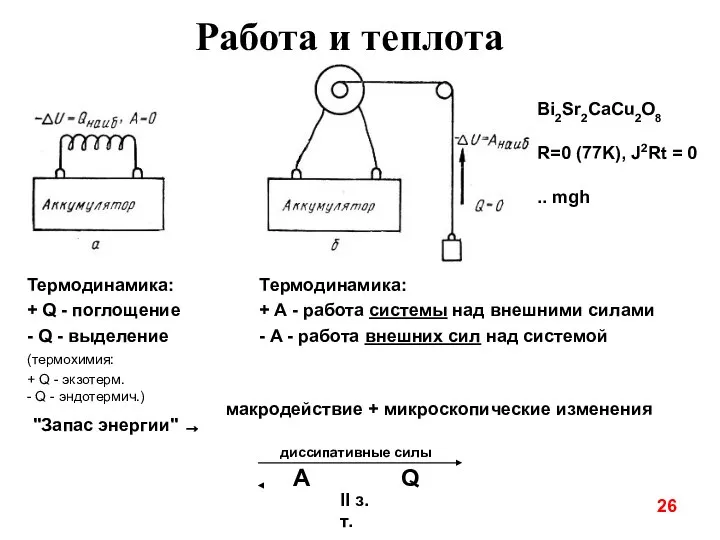
- 27. 26 Работа и теплота Термодинамика: + Q - поглощение - Q - выделение (термохимия: + Q
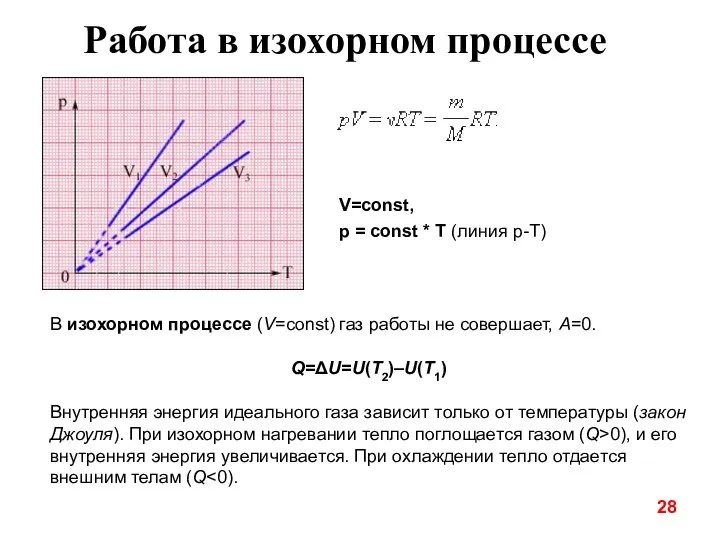
- 28. Работа в изохорном процессе В изохорном процессе (V=const) газ работы не совершает, A=0. Q=ΔU=U(T2)–U(T1) Внутренняя энергия
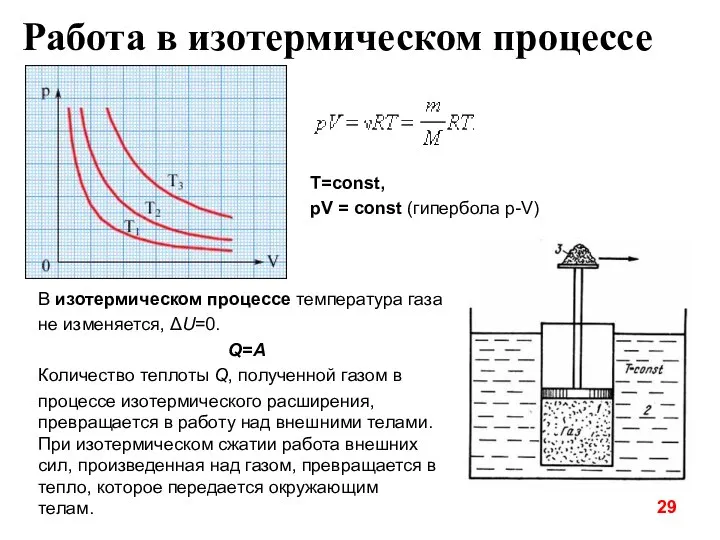
- 29. В изотермическом процессе температура газа не изменяется, ΔU=0. Q=A Количество теплоты Q, полученной газом в процессе
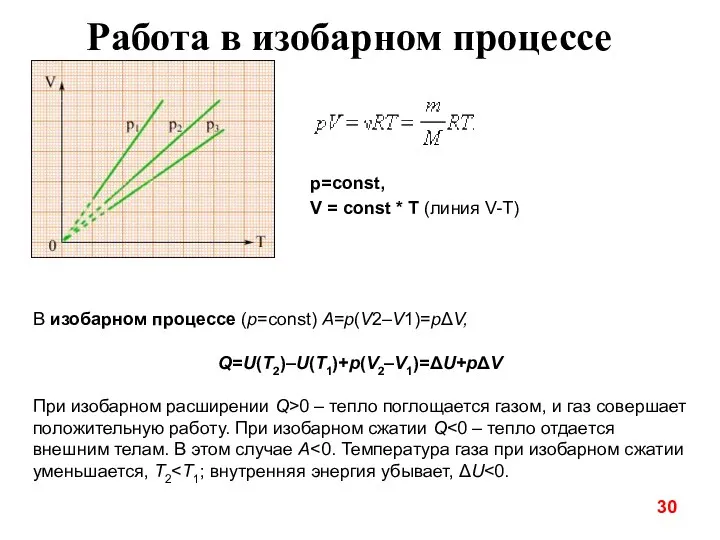
- 30. Работа в изобарном процессе В изобарном процессе (p=const) A=p(V2–V1)=pΔV, Q=U(T2)–U(T1)+p(V2–V1)=ΔU+pΔV При изобарном расширении Q>0 – тепло
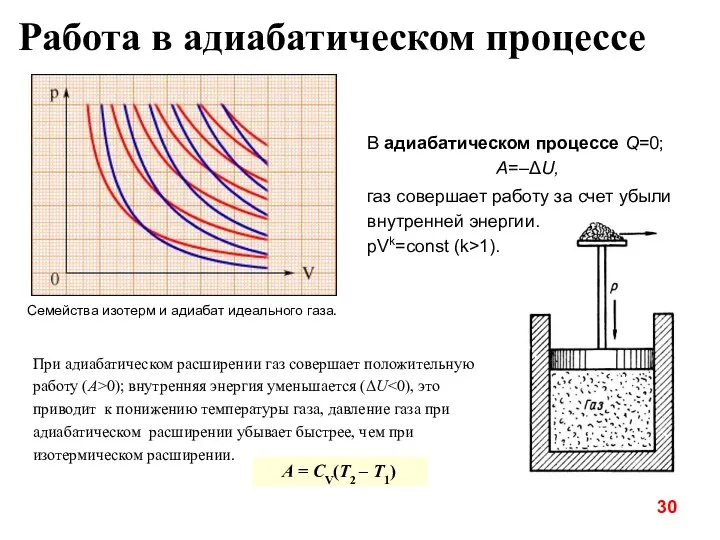
- 31. Работа в адиабатическом процессе Семейства изотерм и адиабат идеального газа. При адиабатическом расширении газ совершает положительную
- 32. Тепловой эффект реакции Тепловой эффект реакции - теплота, выделяющаяся или поглощающая при химической реакции. Условия: p=const
- 33. Совпадение тепловых эффектов при p=const и V=const (ΔU ≈ ΔH), если: -мало изменяется объем (твердые и
- 34. 33 Закон Гесса Тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и
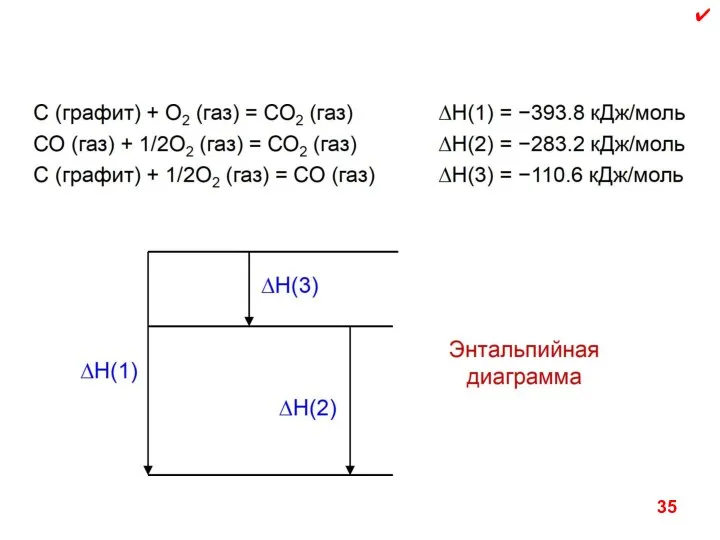
- 35. ✔
- 36. Стандартные условия Нормальные условия (не путать!): 1 атм. = 101325 Па 250С = 298.15К Стандартные условия:
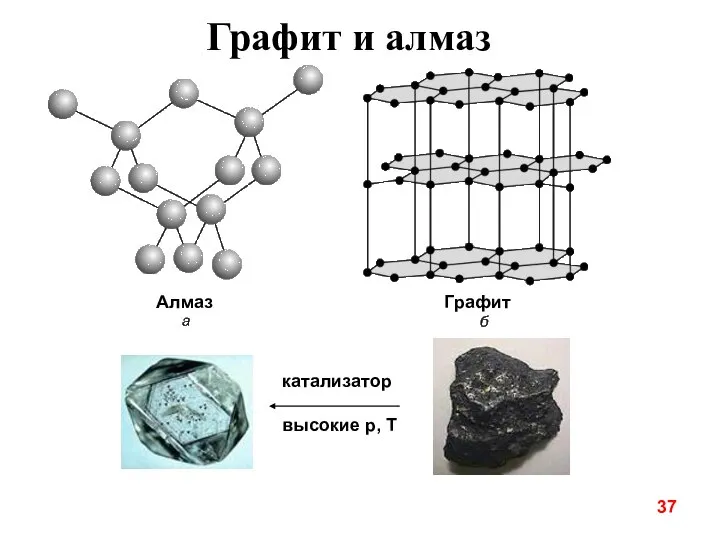
- 37. Графит и алмаз Алмаз Графит катализатор высокие p, T
- 38. ✔
- 39. Сравнение
- 41. Скачать презентацию





















 Определение физических свойств минералов
Определение физических свойств минералов История возникновения химии
История возникновения химии Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче
Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче Строение вещества. Химическая связь
Строение вещества. Химическая связь Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Дисперсные
Дисперсные  Процессы минералообразования
Процессы минералообразования Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Получение, собирание и распознавание водорода
Получение, собирание и распознавание водорода Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_
Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_ Топливо. Виды топлива
Топливо. Виды топлива Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Презентация по Химии "Как определить качество меда" - скачать смотреть
Презентация по Химии "Как определить качество меда" - скачать смотреть  Специфика химии как науки (определение предмета химии)
Специфика химии как науки (определение предмета химии) Викторина «Что это?»
Викторина «Что это?» Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Квантовая механика – теоретическая основа современной химии
Квантовая механика – теоретическая основа современной химии Химические реакции с участием макромолекул
Химические реакции с участием макромолекул Периодическая система элементов Д.И. Менделеева
Периодическая система элементов Д.И. Менделеева Составление электронных формул и электронно-графических схем строения атома
Составление электронных формул и электронно-графических схем строения атома Презентация по Химии "Професії, пов'язані з хімією" - скачать смотреть бесплатно
Презентация по Химии "Професії, пов'язані з хімією" - скачать смотреть бесплатно Тема урока: Сложные эфиры.
Тема урока: Сложные эфиры. Очищение грязной воды
Очищение грязной воды Симметрия физических свойств кристаллов
Симметрия физических свойств кристаллов Химия - основы общей химии (теория)
Химия - основы общей химии (теория) История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Биохимия печени и крови
Биохимия печени и крови Проект на тему «Екзо- та ендотермічні реакції на службі людства»
Проект на тему «Екзо- та ендотермічні реакції на службі людства»