Содержание
- 2. Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе
- 4. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 5. В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей. Соли,
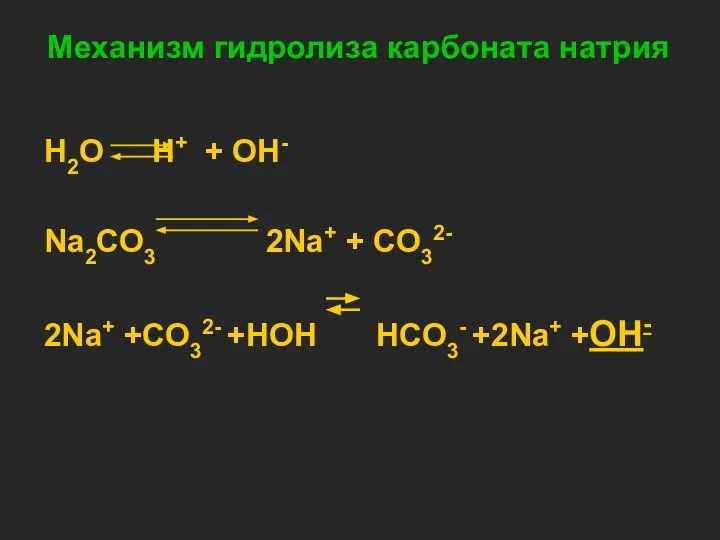
- 6. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 7. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
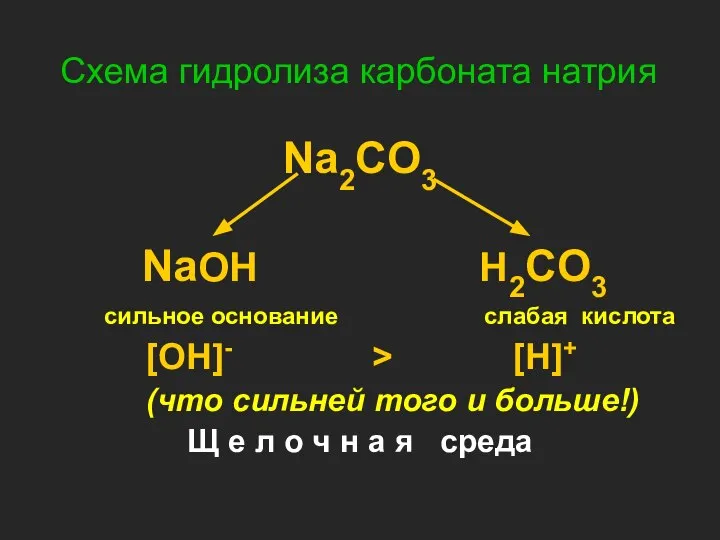
- 8. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 9. FeCl2 ↔ Fe2+ + 2Cl- Fe2+ + H2O ↔ (FeOH)+ + H+ FeCl2 + H2O ↔
- 10. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
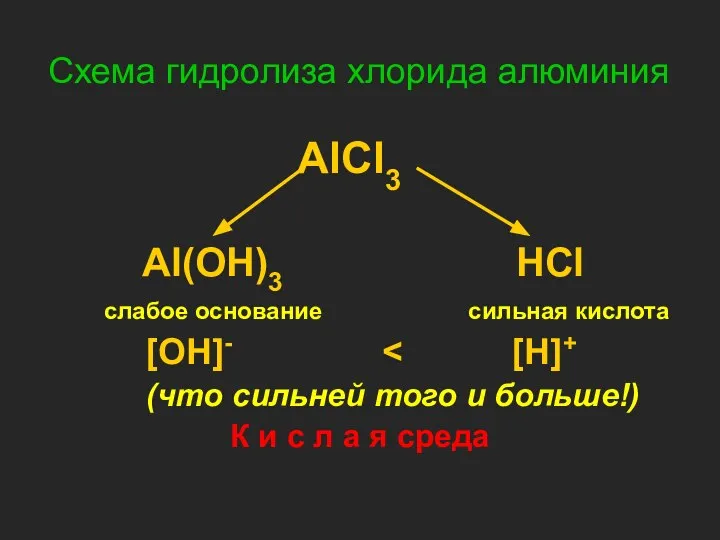
- 12. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
- 13. 4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу. К таким солям
- 14. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 15. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
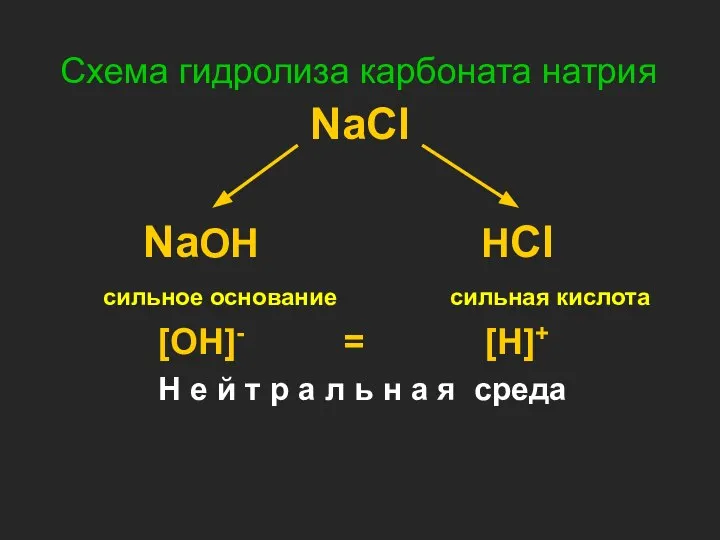
- 16. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
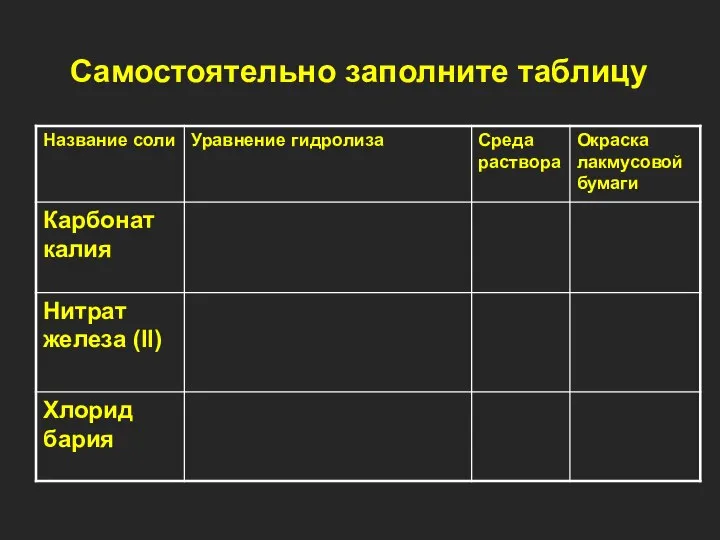
- 17. Самостоятельно заполните таблицу
- 18. Самостоятельно заполните таблицу
- 19. Количественной характеристикой гидролиза является степень гидролиза α (которую выражают в процентах). где n - число моль
- 21. Скачать презентацию













 Гетероциклические соединения
Гетероциклические соединения Химия и проблемы экологии. Кислотные дожди.
Химия и проблемы экологии. Кислотные дожди. Медь и ее сплавы
Медь и ее сплавы Органическая химия. История развития
Органическая химия. История развития Лекція № 2 Білкові системи: характеристика, використання фізико-хімічних властивостей у виробництві харчових продуктів
Лекція № 2 Білкові системи: характеристика, використання фізико-хімічних властивостей у виробництві харчових продуктів Классификация электродов. (Лекция 4)
Классификация электродов. (Лекция 4) Презентация Хлор Cl
Презентация Хлор Cl Многоатомные спирты
Многоатомные спирты Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Методы очистки промышленных сточных вод от ионов тяжелых металлов
Методы очистки промышленных сточных вод от ионов тяжелых металлов Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Вольтамперометрия
Вольтамперометрия Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Керамика на основе Al2O3
Керамика на основе Al2O3 Йодированные производные арилалифатических и ароматических аминокислот
Йодированные производные арилалифатических и ароматических аминокислот Роль органической химии в жизни человека
Роль органической химии в жизни человека Минералогия и кристаллография
Минералогия и кристаллография Ненасыщенные углеводороды этиленового ряда
Ненасыщенные углеводороды этиленового ряда Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Перегонка нефти
Перегонка нефти Депонирование и мобилизация жиров
Депонирование и мобилизация жиров ЭМВИ — прогрессивное направление в области криминалистических исследований
ЭМВИ — прогрессивное направление в области криминалистических исследований Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны
Презентация на тему: «Глюкоза» ученицы 11 класса Широковской ООШ Галаган Юлии Юрьевны  Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы История развития биохимического знания и биохимии как науки
История развития биохимического знания и биохимии как науки Электролиз
Электролиз Нафта
Нафта