Содержание
- 2. СЕРА Аллотропные модификации серы Применение серы Сера в природе Физические свойства Химические свойства Получение серы
- 3. Чтобы изучить свойства вещества необходимо знать его электронное строение Лайнус Полинг
- 4. ПЛАН ХАРАКТЕРИСТИКИ 1. Название, химический символ и относительная атомная масса элемента. 2. Атомный (порядковый) номер. 3.
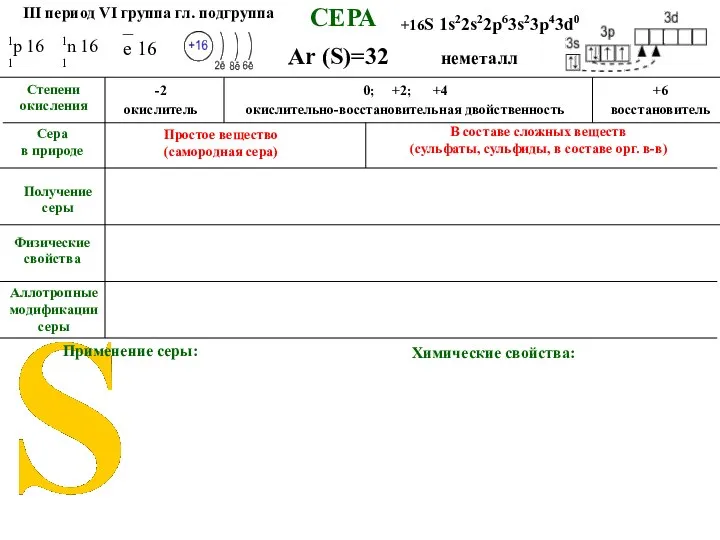
- 5. СЕРА Аллотропные модификации серы Ar (S)=32 Сера в природе Применение серы Химические свойства неметалл III период
- 6. Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Доказал сложный
- 7. СЕРА В ПРИРОДЕ «Нет ни единой руды, нет почти ни единого камня, который бы через взаимное
- 8. ПРИРОДНЫЕ МЕСТОРОЖДЕНИЯ СЕРЫ
- 9. МЕСТОРОЖДЕНИЯ СЕРЫ В САМАРСКОЙ ОБЛАСТИ
- 10. СЕРА Аллотропные модификации серы Ar (S)=32 Применение серы: Степени окисления Сера в природе Получение серы Простое
- 11. ПОЛУЧЕНИЕ СЕРЫ Метод Фраша. Выплавление серы под землёй с помощью водяного пара и выкачивание на поверхность
- 12. СЕРА Аллотропные модификации серы Ar (S)=32 Применение серы: Степени окисления Сера в природе Простое вещество (самородная
- 13. КРИСТАЛЛИЧЕСКАЯ СЕРА
- 14. СЕРА Светло-желтое хрупкое твердое вещество, имеет специфический запах, tпл = 112,8 °C, tкип = 444,674 °C,
- 15. РОМБИЧЕСКАЯ СЕРА АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ МОНОКЛИННАЯ СЕРА Игольчатые кристаллы, t°пл. = 119°C; ρ = 1,96 г/см3.
- 17. РОМБИЧЕСКАЯ СЕРА АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ МОНОКЛИННАЯ СЕРА ПЛАСТИЧЕСКАЯ СЕРА Игольчатые кристаллы, t°пл. = 119°C; ρ =
- 18. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
- 19. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Hg + S = HgS (при н.у. медленно) 2Al +
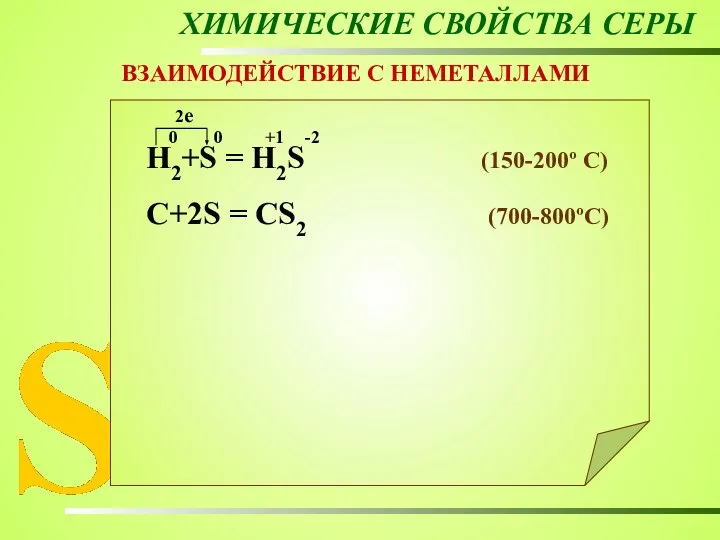
- 20. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S = Н2S (150-200º C) C+2S = CS2 (700-800ºC) 0
- 21. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
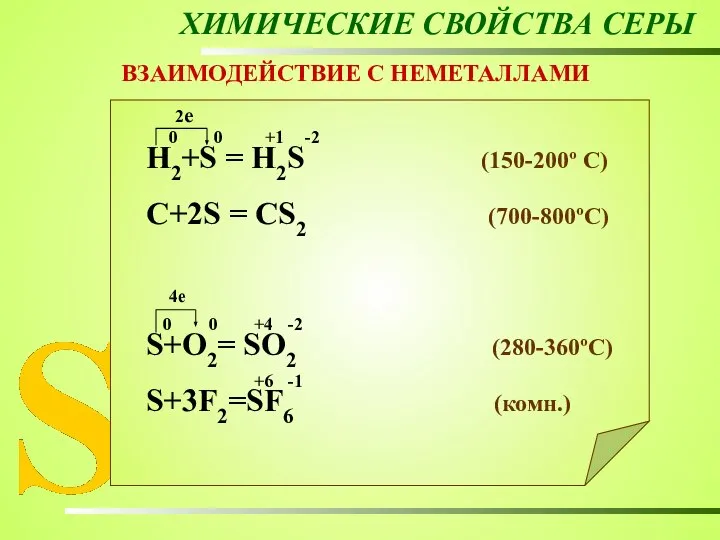
- 22. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S = Н2S (150-200º C) C+2S = CS2 (700-800ºC) S+O2=
- 23. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
- 24. ПРИМЕНЕНИЕ СЕРЫ «Сера - двигатель химической промышленности» А.Е.Ферсман Для того чтобы изготовить автомобиль, нужно израсходовать около
- 25. БИОЛОГИЧЕСКАЯ РОЛЬ СЕРЫ Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
- 26. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
- 27. Интернет: http://ru.wikipedia.org; http://links.alhimik.ru/teleclass http://mediateka.km.ru/bes_2002 http://him.1september.ru; http://bizinfo.otrok.ru http://www.alhimik.ru/teleclass/konspect http://www.rossibneft.ru/showpage/sprav/chem CD: «Виртуальная лаборатория 9 класс»; «Базовый курс химии
- 29. Скачать презентацию






















 Radiation dosimetry
Radiation dosimetry Биоэнергетика. Часть первая
Биоэнергетика. Часть первая Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Липиды. Классификация липидов
Липиды. Классификация липидов Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електро
Класифікація вуглеводнів. Утворення ковалентних карбон-карбонових зв’язків у органічних сполуках. Види гібридизації електро Кислород
Кислород Фазовые диаграммы трехкомпонентных систем
Фазовые диаграммы трехкомпонентных систем Будова атома
Будова атома Переработка гидроминерального сырья
Переработка гидроминерального сырья Процессы нитрования
Процессы нитрования Карбонові кислоти. Насичені карбонові кислоти
Карбонові кислоти. Насичені карбонові кислоти Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Презентация Угольная кислота
Презентация Угольная кислота Дисахариды, моносахариды
Дисахариды, моносахариды «Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска
«Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска Атомдар мен молекулалар
Атомдар мен молекулалар Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста Железо
Железо Предельные углеводороды
Предельные углеводороды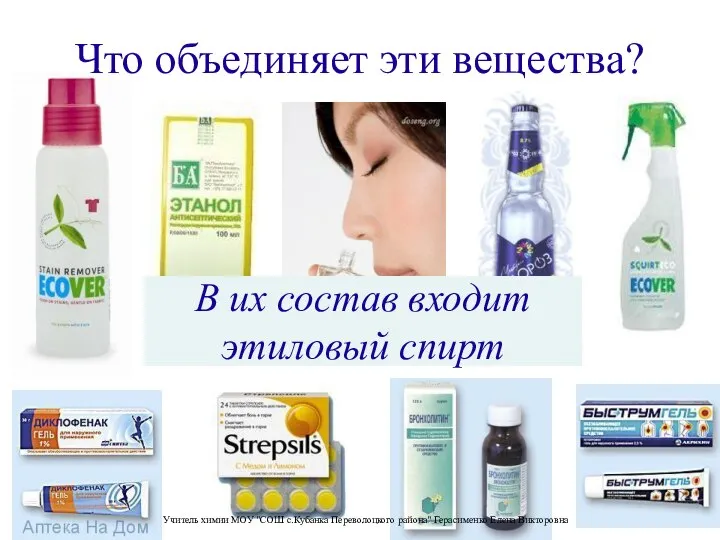 Что объединяет эти вещества?
Что объединяет эти вещества?  Презентация "Основания"
Презентация "Основания" Антибиотики. Действие антибиотиков
Антибиотики. Действие антибиотиков Важнейшие минералы
Важнейшие минералы Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Гліцерин (Гліцерол)
Гліцерин (Гліцерол) Классификация автомобильных масел
Классификация автомобильных масел Неорганические и органические основания.
Неорганические и органические основания.