Содержание
- 2. УДК 546.04 ББК 24.1 Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ) Рекомендовано к изданию кафедрой неорганической
- 3. Растворы Общие свойства растворов
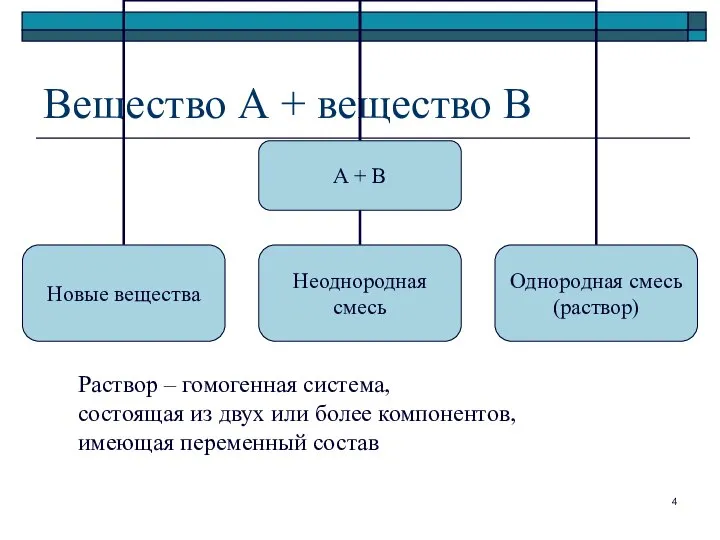
- 4. Вещество А + вещество В Раствор – гомогенная система, состоящая из двух или более компонентов, имеющая
- 5. Смеси веществ Смеси Грубодисперсные системы (взвеси) Тонкодисперсные системы (коллоидные системы) Истинные растворы Размеры частиц более 100
- 6. Грубодисперсные системы Дисперсионная среда – газообразная Дисперсная фаза: твердая – пыль, дым, порошок жидкая – смог,
- 7. Истинные растворы Агрегатное состояние: газообразные, жидкие, твердые растворы Состав раствора: растворитель + растворенное вещество Параметры раствора:
- 8. Количественный состав раствора Массовая доля Молярная концентрация (молярность) Эквивалентная концентрация (нормальность) Коэффициент растворимости Мольная доля Массовая
- 9. Растворы Идеальные ΔV = 0; ΔQ = 0 Реальные ΔV ≠ 0 1 л H2O +
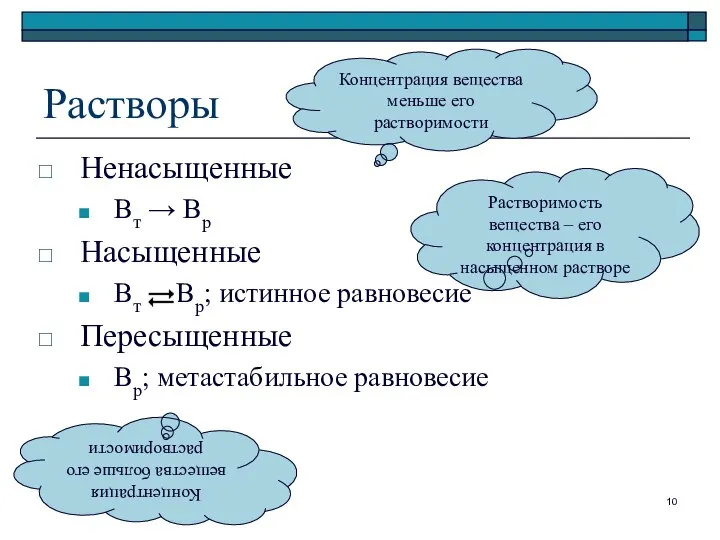
- 10. Растворы Ненасыщенные Вт → Вр Насыщенные Вт Вр; истинное равновесие Пересыщенные Вр; метастабильное равновесие Концентрация вещества
- 11. Растворимость газов в жидкостях Если нет химического взаимодействия Ar(г) Ar(р) Влияние давления Δν = −1 Увеличение
- 12. Растворимость газов в жидкостях Влияние температуры Qразрыв связей ≈ 0 Qобразование связей > 0 Процесс экзотермический
- 13. Растворимость газов в жидкостях Если есть химическое взаимодействие Cl2(г) Cl2(р) Cl2(р) + 2Н2О Н3О+ + Cl−
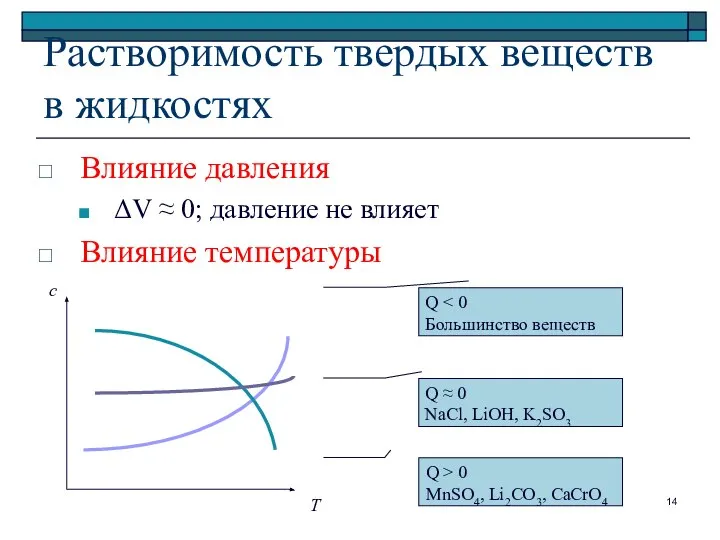
- 14. Растворимость твердых веществ в жидкостях Влияние давления ΔV ≈ 0; давление не влияет Влияние температуры Т
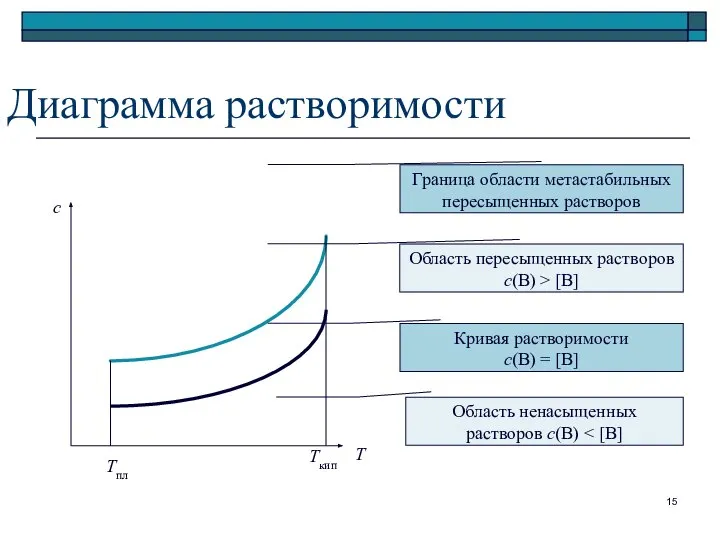
- 15. Диаграмма растворимости Т с Тпл Ткип Граница области метастабильных пересыщенных растворов Область пересыщенных растворов c(B) >
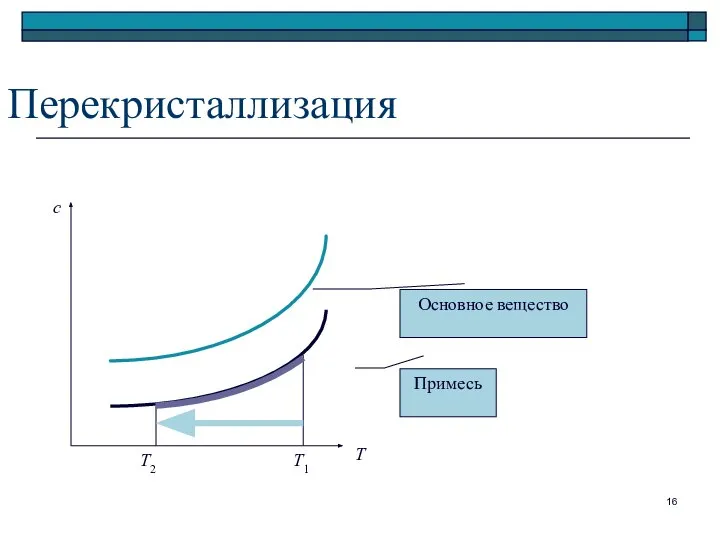
- 16. Перекристаллизация Т с Т2 Т1 Основное вещество Примесь
- 17. Растворы электролитов Электролитическая диссоциация
- 18. Сильные электролиты MA → M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень
- 19. Слабые электролиты MA → MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] Степень
- 20. Слабые электролиты MxAy(р) x Ma+(р) + y Ab–(р) Константа диссоциации KD :
- 21. Закон разбавления Оствальда МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–]
- 22. Гетерогенные ионные равновесия М+ + А– ↑↓ МА(т) МА(т) М+ + А– Для малорастворимых сильных электролитов:
- 23. Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y
- 24. Задача Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Ag2SO4(т) ⮀ 2Ag+ + SO42–
- 25. Т Условия осаждения и растворения осадков с с(М+) с(А–) = [M+] [А–] = ПР с(М+) с(А–)
- 26. Введение одноименного иона МхАу(т) х Ма+ + у Аb– Увеличение с(Ма+) или с(Аb–) Сдвиг равновесия в
- 27. Удаление одноименного иона МхАу(т) х Ма+ + у Аb– Уменьшение с(Ма+) или с(Аb–) Сдвиг равновесия в
- 28. Удаление одноименного иона Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде
- 29. Переосаждение PO43– Ag2SO4(т) Ag3PO4(т) SO42– 3 Ag2SO4(т) + 2 PO43– 2 Ag3PO4(т) + 3 SO42– (1)
- 30. В каком минимальном объеме воды можно растворить 1 г гипса? Условие задачи V(H2O) = ? m(CaSO4.2H2O)
- 31. Выпадет ли осадок при сливании равных объемов миллимолярных растворов нитрата серебра(I) и хлорида натрия? 1/2 c0(AgNO3)
- 32. Протолитическая теория кислот и оснований 1923 г. Йоханес Брёнстед Томас Лаури
- 33. Протолитическая теория кислотные или основные свойства частиц обусловлены их способностью отдавать или присоединять катион водорода (протон
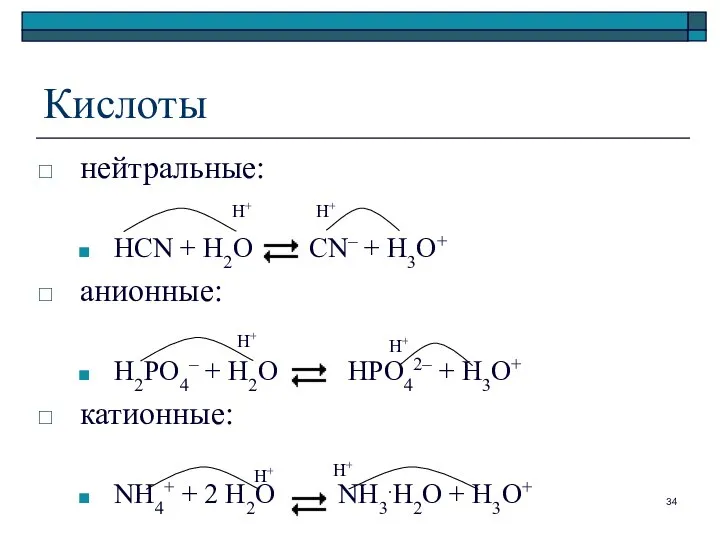
- 34. Кислоты нейтральные: HCN + H2O CN– + H3O+ анионные: H2PO4– + H2O HPO42– + H3O+ катионные:
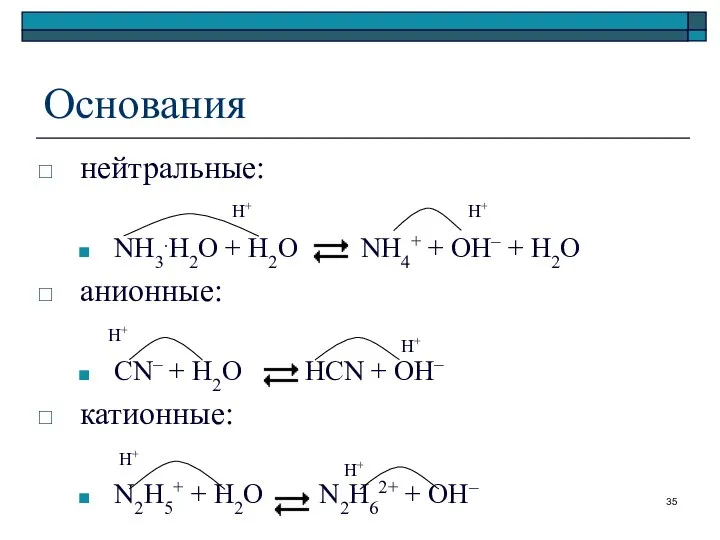
- 35. Основания нейтральные: NH3.H2O + H2O NH4+ + OH– + H2O анионные: CN– + H2O HCN +
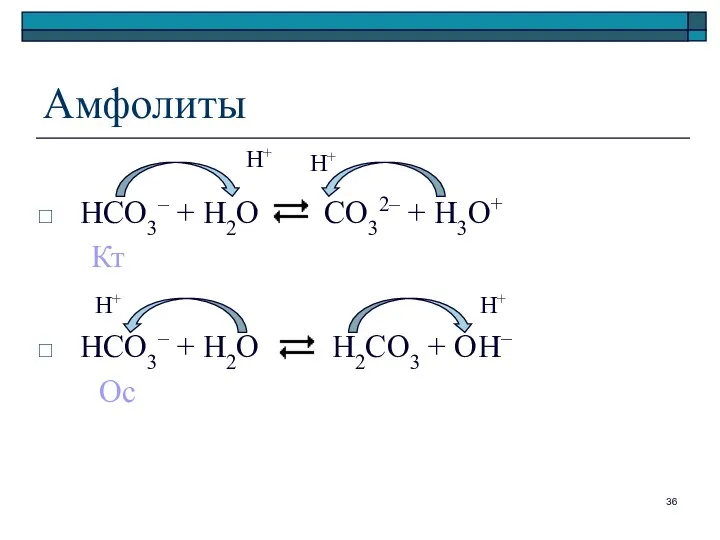
- 36. Амфолиты HCO3– + H2O CO32– + H3O+ Кт HCO3– + H2O H2CO3 + OH– Ос Н+
- 37. Растворители Апротонные: C6H6, CS2, CCl4 Протонные H2O, NH3, C2H5OH (амфолиты) Автопротолиз: HL + HL H2L+ +
- 38. Ионное произведение воды H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 °С):
- 39. Водородный показатель (рН) рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–]
- 40. Водородный показатель (рН) В чистой воде при 25°С рН = рОН = 7 Среда нейтральная Если
- 41. Шкала рН При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1
- 42. Константа кислотности HA + H2O A– + H3O+ H+ H+
- 43. B(OH)3.H2O + H2O [B(OH)4]– + H3O+ Слабые кислоты Сопряженная пара KК СН3СООН / СН3СОО– 1,7.10–5 Al3+.H2O
- 44. Сильные кислоты HA + H2O = A– + H3O+ Бескилородные кислоты: HCl, HBr, HI Кислородсодержащие кислоты
- 45. HClO4 + CH3COOH ClO4– + CH3COOH2+ HNO3 + CH3COOH NO3– + CH3COOH2+ Сила кислот в неводных
- 46. Константа основности A– + H2O HA + ОН– H+ H+
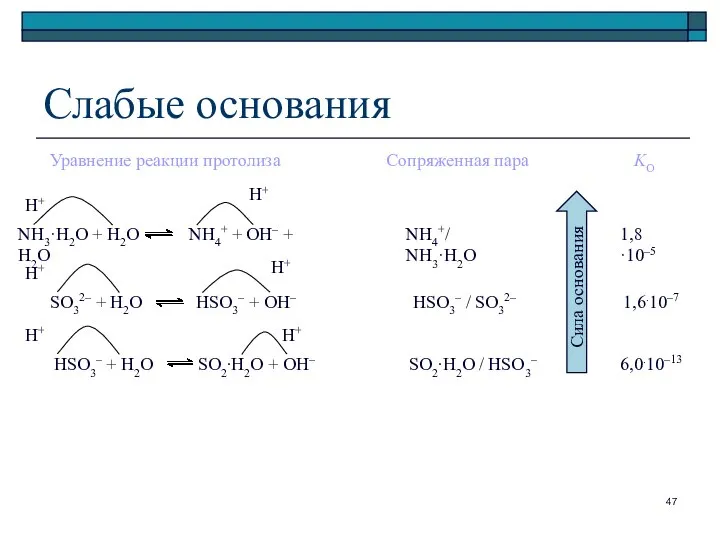
- 47. HSO3– + H2O SO2∙H2O + OH– SO32– + H2O HSO3– + OH– NH3·H2O + H2O NH4+
- 48. Сильные основания Анионы: амид-ион NH2– метилат-ион CH3O– и другие алкоголят-ионы гидроксид-ион ОН– Соединения, дающие эти ионы
- 49. Малорастворимые гидроксиды Ni(OH)2(т) Ni2+ + 2OH— Слабое основание? Сильное основание? ПР = [Ni2+][OH—]2
- 50. Связь Kк и Ko для пары НА/А– [H3O+] [A–] [HA] [OH–] KК ▪KO = ––––––––––▪ ––––––––––
- 51. Степень протолиза (α) – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц Для реакции протолиза
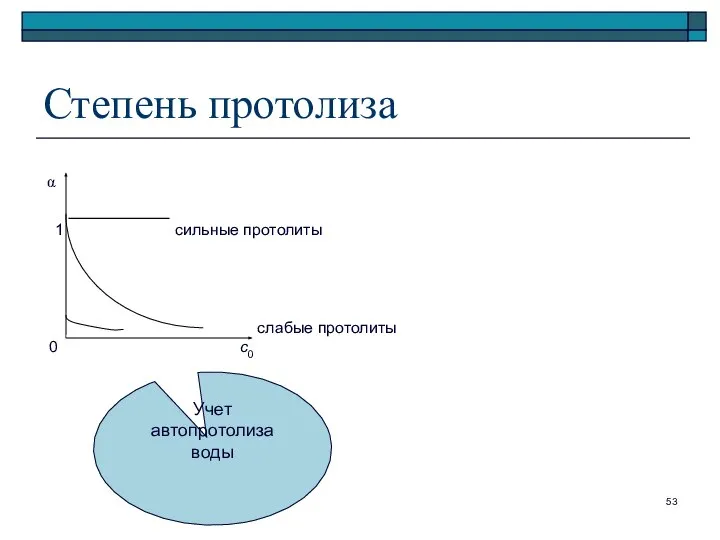
- 52. Закон разбавления Оствальда При α _____ α = √Kк / c0
- 53. Степень протолиза α 1 сильные протолиты слабые протолиты 0 с0 Учет автопротолиза воды
- 54. Учет автопротолиза воды HA + H2O A– + H3O+ H2O + H2O OH– + H3O+ H+
- 55. Учет автопротолиза воды Kкc0 – Kк[A–] = [A–][H3O+]
- 56. Учет автопротолиза воды При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7 моль/л при Kк ≥
- 57. Сдвиг протолитических равновесий Изменение концентрации слабого протолита закон разбавления Оствальда разбавление Изменение температуры протолиз – эндотермический
- 58. Сдвиг протолитических равновесий Протолиз слабой кислоты в присутствии сильной кислоты: HA + H2O A– + H3O+
- 59. Определите рН в 0,001 М растворе серной кислоты. H2SO4 + 2H2O = SO42− + 2H3O+ с0(H2SO4)
- 60. Определите рН в растворе азотной кислоты с концентрацией с0 = 1.10–11 моль/л. HNO3 + H2O =
- 61. Определите рН в 0,002М растворе хлорноватистой кислоты при 25 °C. HClO + H2O ClO– + Н3O+;
- 62. Определите pH в 0,002М растворе аммиака при 25 °С. KK = 5,75 . 10–10 KB =
- 63. Обратимый гидролиз солей 1. Диссоциация 2. Протолиз
- 64. Гидролиз солей KCl = K+ + Cl– непротолиты Нет гидролиза, нейтральная среда, рН 7 NH4NO3 =
- 65. Гидролиз солей ZnSO4 = Zn2+ + SO42– Zn2+.H2O + H2O ZnOH+ + H3O+ Гидролиз по катиону,
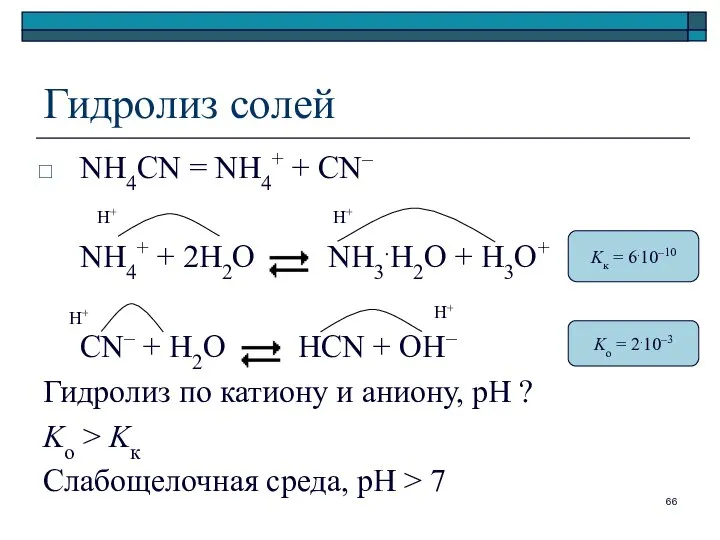
- 66. Гидролиз солей NH4CN = NH4+ + CN– NH4+ + 2H2O NH3.H2O + H3O+ CN– + H2O
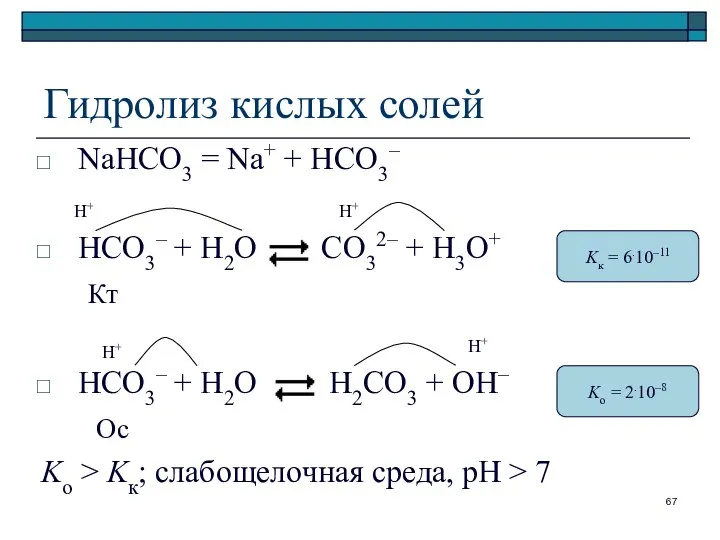
- 67. Гидролиз кислых солей NaHCO3 = Na+ + HCO3– HCO3– + H2O CO32– + H3O+ Кт HCO3–
- 68. Гидролиз солей Усиление (α↑) Повышение температуры Понижение концентрации Связывание одноименных ионов Ослабление (α↓) Понижение температуры Повышение
- 69. Необратимый гидролиз PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) H2[PHO3] + H2O H[PHO3]– + H3O+ HCl
- 70. Необратимый гидролиз Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2 NH3·H2O + H2O NH4+ + OH– +
- 71. Необратимый гидролиз Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑ Совместный гидролиз: 2Al3+ +3S2– + 6H2O =
- 72. Определите рН 0,1 М раствора хлорида железа(III). FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O
- 73. Определите рН 0,1 М раствора хлорида железа(III). Более строгий подход: если считать [Fe3+] = с0(1 –
- 74. Определите рН 0,1 М раствора хлорида железа(III). При с0 = 0,1 моль /л и Kк =
- 75. FeCl3 + H2O + Zn = ? FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O
- 76. Определите рН в 0,1 М растворе ортофосфата натрия. Na3PO4 = 3 Na+ + PO43– PO43– +
- 77. Na3PO4 + H2O + Zn = ? Na3PO4 (т) = 3 Na+ + PO43– PO43– +
- 78. Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия. CH3COONa = Na+
- 79. Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия. pH = –
- 80. Определите pH в водном растворе NaHA HA– – амфолит (HCO3–, HS–, H2PO4–, HPO42– и т.д.) Диссоциация:
- 81. Определите pH в водном растворе NaHA Без вывода: рН не зависит от концентрации амфолита Буферный раствор
- 82. HA– pKк(H2A/HA–) pKк(HA–/A2–) pH HCO3– 6,37 10,33 8,35 HSO3– 1,78 7,20 4,49 HS– 6,98 12,91 9,94
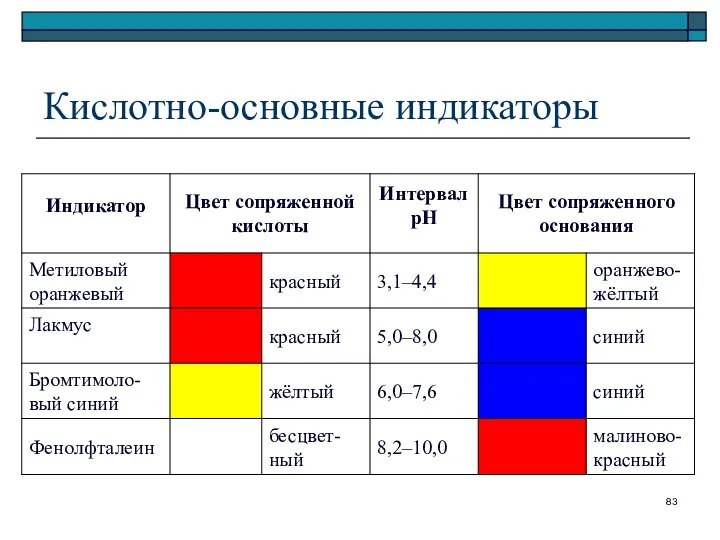
- 83. Кислотно-основные индикаторы
- 85. Скачать презентацию











![Сильные электролиты MA → M+(р) + A–(р) [MA] = 0, [M+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-17.jpg)
![Слабые электролиты MA → MA(р) + M+(р) + A–(р) [MA] >](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-18.jpg)

![Закон разбавления Оствальда МА М+ + А– [M+] [A–] KD =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-20.jpg)

![Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-22.jpg)

![Т Условия осаждения и растворения осадков с с(М+) с(А–) = [M+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-24.jpg)










![Водородный показатель (рН) рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-38.jpg)

![Шкала рН При [H3O+] = 0,1 моль/л (например, в 0,1 М](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-40.jpg)

![B(OH)3.H2O + H2O [B(OH)4]– + H3O+ Слабые кислоты Сопряженная пара KК](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-42.jpg)




![Малорастворимые гидроксиды Ni(OH)2(т) Ni2+ + 2OH— Слабое основание? Сильное основание? ПР = [Ni2+][OH—]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-48.jpg)
![Связь Kк и Ko для пары НА/А– [H3O+] [A–] [HA] [OH–]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-49.jpg)



![Учет автопротолиза воды Kкc0 – Kк[A–] = [A–][H3O+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-54.jpg)
![Учет автопротолиза воды При бесконечном разбавлении: с0 → 0; [H3O+] →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-55.jpg)










 + 3HCl(p) H2[PHO3] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1259633/slide-68.jpg)













 Презентация Подгруппа углерода и азота
Презентация Подгруппа углерода и азота Химические свойства Способы получения
Химические свойства Способы получения Полимеры 11 класс
Полимеры 11 класс Введение. Физическая и коллоидная химия, ее содержание, задачи, объекты и методы их изучения
Введение. Физическая и коллоидная химия, ее содержание, задачи, объекты и методы их изучения Кристаллизация металла шва
Кристаллизация металла шва Пятичленные гетероциклы с двумя гетероатомами - азолы
Пятичленные гетероциклы с двумя гетероатомами - азолы Строение атома, изотопы
Строение атома, изотопы Репликация ДНК. Элонгация репликации ДНК. (Лекция 4)
Репликация ДНК. Элонгация репликации ДНК. (Лекция 4) Амедео Авогадро
Амедео Авогадро Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Центрифугирование. Его использование в разных направлениях биологии
Центрифугирование. Его использование в разных направлениях биологии Катионы IV аналитической группы
Катионы IV аналитической группы Алканы (структурная изомерия и систематическая номенклатура)
Алканы (структурная изомерия и систематическая номенклатура) Использование разнообразных форм и средств контроля за качеством образования на уроках химии
Использование разнообразных форм и средств контроля за качеством образования на уроках химии Свойства, получение и применение алканов. Циклоалканы
Свойства, получение и применение алканов. Циклоалканы СРСП Терпендер дәрілік препараттары және олардың туындыларының анализы
СРСП Терпендер дәрілік препараттары және олардың туындыларының анализы Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Коррозия металлов
Коррозия металлов Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем ЭМВИ — прогрессивное направление в области криминалистических исследований
ЭМВИ — прогрессивное направление в области криминалистических исследований Пластмаси
Пластмаси  Фараонова Змея
Фараонова Змея Типы и механизмы органических реакций
Типы и механизмы органических реакций Проблемы загрязнения воды Ташбаев Далерхан 7 «А»
Проблемы загрязнения воды Ташбаев Далерхан 7 «А» Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна
Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна  Сложные эфиры Урок – семинар обобщения знаний в 10 биолого-химическом классе
Сложные эфиры Урок – семинар обобщения знаний в 10 биолого-химическом классе