Содержание
- 2. Разделы дисциплины ХИМИЯ Физическая химия Органическая химия Аналитическая химия
- 3. Физическая и коллоидная химия, ее содержание, задачи, объекты и методы их изучения. Роль российских и зарубежных
- 4. Физическая химия – наука, которая изучает общие закономерности физических процессов и является теоретической основой всей химической
- 5. Разделы физхимии Строение вещества. Химическая термодинамика Химическая кинетика Учение о растворах Электрохимия Коллоидная химия
- 6. Строение вещества. В этот раздел входят учение о строении атомов и молекул и учение об агрегатных
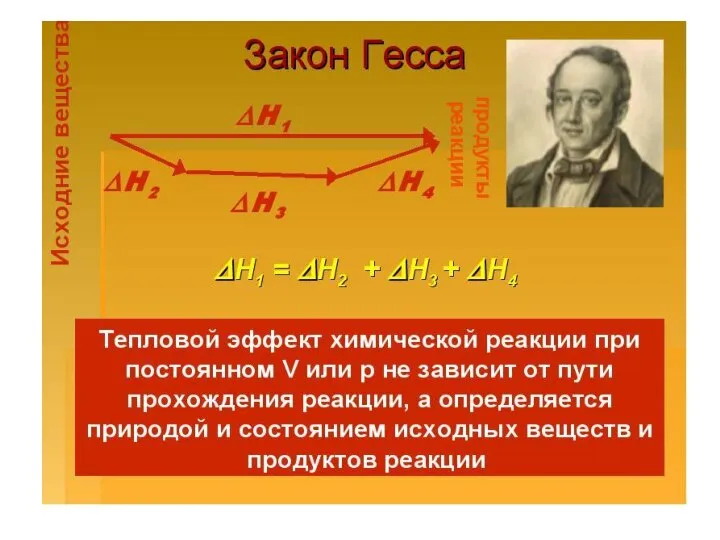
- 7. Химическая термодинамика изучает энергетические эффекты химических процессов; позволяет определить возможность, направление и глубину протекания химического процесса
- 8. Химическая кинетика. В этом разделе физической химии изучается скорость и механизм протекания химических процессов в различных
- 9. Учение о растворах рассматривает процессы образования растворов, их внутреннюю структуру и важнейшие свойства, зависимость структуры и
- 10. Электрохимия изучает особенности свойств растворов электролитов, явления электропроводности, электролиза, коррозии, работу гальванических элементов.
- 11. Коллоидная химия изучает поверхностные явления и свойства мелкодисперсных гетерогенных систем. Все разделы физической химии объединяет единая
- 12. Строение вещества Строение атома Строение молекулы, иона. Агрегатное состояние. Уравнение реакций и расчеты по ним. Атомная
- 13. Термодинамика Термодинамика – один из важнейших разделов физики и физической химии, предметом изучения которого являются: А)
- 14. Термодинамика построена Термодинамика построена: на двух основных законах называемых первым и вторым началами, на постулате Планка,
- 15. термодинамика покоится на методе дедуктивного мышления (от общего – к частному). она действует по принципу «черного
- 16. Предметом химической термодинамики Предметом химической термодинамики служит термодинамическое рассмотрение явлений, относящихся к области химии. Термодинамика приложима
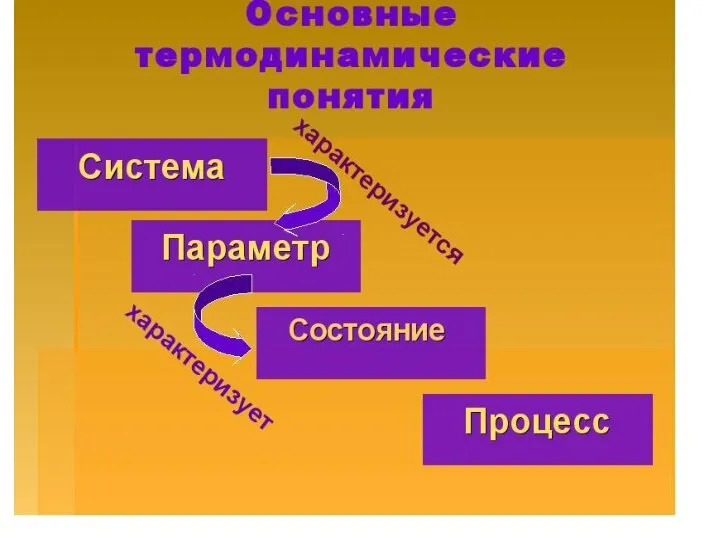
- 17. Система Одно из основных понятий термодинамики связано с определением «системы». Система – тело или группа тел,
- 18. Изолированные системы Изолированные системы – это системы, имеющие постоянный объем, через границы которых не происходит обмена
- 19. Состояние системы Состояние системы определяется ее свойствами (термодинамическими параметрами). Свойства системы зависят только от ее начального
- 20. Интенсивные свойства не зависят от количества вещества, не аддитивны. К ним относятся температура, давление, плотность. Исходя
- 21. Переход системы Переход системы из одного состояния в другое называют процессом. Если при его проведении изменяется
- 22. понятия теплоты и работы К весьма важным в термодинамике относятся понятия теплоты и работы. Они не
- 23. внутренняя энергия U Одним из наиболее фундаментальных термодинамических понятий является внутренняя энергия U. Она относится к
- 24. Первый закон термодинамики Первый закон термодинамики устанавливает связь между количеством получаемой или выделяемой теплоты, количеством произведенной
- 25. Имеются и другие, равноценные, формулировки первого закона. Одна из них – формулировка закона сохранения энергии: если
- 26. Второй закон термодинамики показывает, в каком направлении в заданных условиях (температура, давление, концентрация и т. д.)
- 27. В общем случае самопроизвольное развитие взаимодействия между различными частями системы возможно только в направлений выравнивания интенсивных
- 28. В курсах термодинамики показывается, что энтропия является мерой беспорядка в изолированной системе, мерой ее термодинамической вероятности,
- 29. Другими словами, в системе с постоянными температурой и давлением самопроизвольно могут протекать только процессы, сопровождаемые уменьшением
- 30. Второй закон термодинамики указывает направление возможного процесса но ничего не сообщает о его скорости. Между тем
- 31. Лекция №2 Химическая термодинамика. Химическая кинетика и катализ ПЛАН 1. Основные понятия термодинамики. 2. Термохимия. 3.
- 32. Термодинамика – это раздел физики, изучающей взаимные преобразования различных видов энергии, связанных с переходом энергии в
- 33. Основные термодинамические понятия Система
- 34. Внутренняя энергия Внутренняя энергия - кинетическая энергия всех частиц системы (молекул, атомов, электронов) и потенциальная энергия
- 35. Первый закон термодинамики Энергия не исчезает бесследно и не возникает из ничего, а только переходит из
- 40. Энтропия – термодинамическая функция состояния, поэтому ее изменение не зависит от пути процесса, а определяется только
- 42. Скачать презентацию





































 Свойства металлов и сплавов
Свойства металлов и сплавов Скорость химических реакций. 9 класс
Скорость химических реакций. 9 класс Арены. Природные источники углеводородов
Арены. Природные источники углеводородов Химические реакции. Скорость химической реакции
Химические реакции. Скорость химической реакции Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Промышленная очистка воды
Промышленная очистка воды Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды Образование кристаллов. Выращивание монокристаллов (лекция 11)
Образование кристаллов. Выращивание монокристаллов (лекция 11) Разбор сложных заданий ЕГЭ по химии
Разбор сложных заданий ЕГЭ по химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ  Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64
Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64 Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Ниобий. Физиологическое действие
Ниобий. Физиологическое действие Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть  Амины. Номенклатура аминов
Амины. Номенклатура аминов Судың құрамы және физикалық қасиеттері
Судың құрамы және физикалық қасиеттері Алкены
Алкены Липиды. Классификация липидов
Липиды. Классификация липидов Общие сведения о месторождениях полезных ископаемых
Общие сведения о месторождениях полезных ископаемых Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Презентация Степень окисления
Презентация Степень окисления  Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Алканы. Предельные углеводороды
Алканы. Предельные углеводороды Весы. Камни Весов
Весы. Камни Весов