Содержание
- 2. Ученик, который учится без желания, - это птица без крыльев. Шестерых я слуг имел, И все
- 3. …металл, «капнувший с неба» … «Металл – и плуг в поле, и гвоздь в доме»
- 4. В таблице Д.И. Менделеева трудно найти какой-либо иной элемент, с которым так неразрывно связывалась бы жизнь
- 5. Но железо – не только борьба, война, разрушения. Железо – металл созидания, железо – основа всей
- 6. Всё, всё – начиная от швейной иглы и кончая паутиной железных дорог, авианосцами, огнедышащими домнами, где
- 7. ЖЕЛЕЗО – ГЛАВНЫЙ МЕТАЛЛ НАШЕГО ВРЕМЕНИ
- 8. Цели урока Охарактеризовать элемент железо, исходя из его положения в таблице Менделеева Узнать, где находится железо
- 9. Задачи урока Выполнить задания своей группы Составить конспект по теме «Железо» Ответить на вопросы теста Оценить
- 10. Задания группам 1 группа 1. Характеристика элемента железо 2. Нахождение элемента железо в природе 2 группа
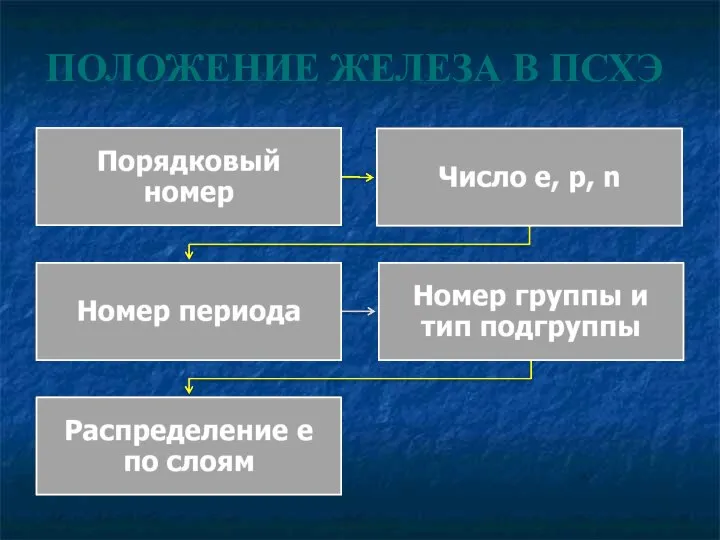
- 11. ПОЛОЖЕНИЕ ЖЕЛЕЗА В ПСХЭ
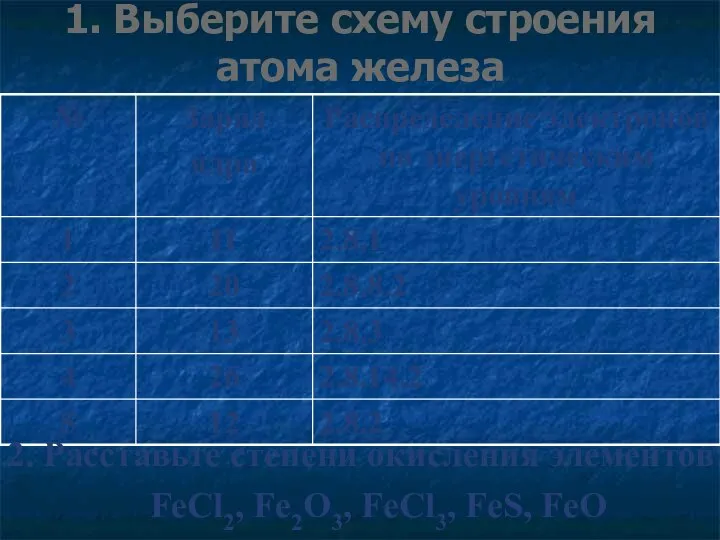
- 12. 1. Выберите схему строения атома железа 2. Расставьте степени окисления элементов: FeCl2, Fe2O3, FeCl3, FeS, FeO
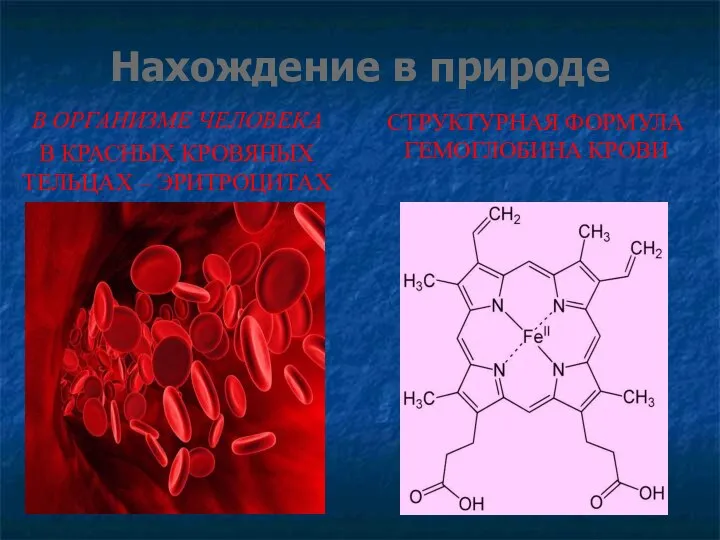
- 13. Нахождение в природе В ОРГАНИЗМЕ ЧЕЛОВЕКА В КРАСНЫХ КРОВЯНЫХ ТЕЛЬЦАХ – ЭРИТРОЦИТАХ СТРУКТУРНАЯ ФОРМУЛА ГЕМОГЛОБИНА КРОВИ
- 14. …в растениях Железо влияет на процесс фотосинтеза
- 15. Весело зеленеют листья растений
- 16. и ярко румянятся щечки человека
- 17. Назван по имени мифического греческого пастуха Магнеса, впервые нашедшего этот минерал МагнетитFe3O4
- 18. кошачье золото золото дурака Трудно поверить, что высший класс огранки и полировки, поражающий нас в рукотворных
- 19. Лимонит Fe2O3
- 20. или кровавик У магов он служит для вычерчивания на полу магического круга и тайных знаков. Гематит
- 28. 1. Как называется болезнь, когда не хватает организму железа? ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ. 2. Встречается ли железо в
- 29. Домашнее задание §14, с. 68 З. 5 Задание по желанию Составить мини-сочинение, рекламный ролик, рекламный проспект,
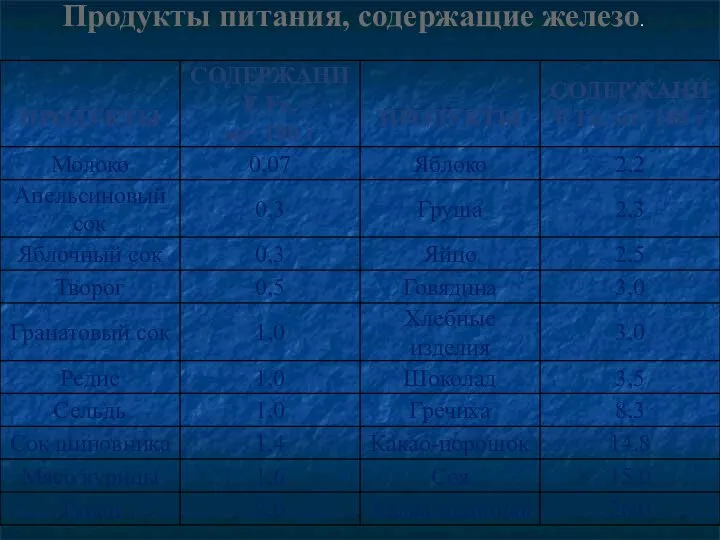
- 30. . Продукты питания, содержащие железо.
- 33. 1. У этого металла последние электроны заполняют не внешний, а предвнешний энергетический уровень. 2. На внешнем
- 34. 9. Этот металл образует металлическую кристаллическую решетку и металлическую связь. 10. На внешнем энергетическом уровне у
- 36. Скачать презентацию




























 Презентация по Химии "«Самородки»" - скачать смотреть
Презентация по Химии "«Самородки»" - скачать смотреть  Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання
Самозаймання речовин та матеріалів. Особливості самозаймання. Види самозаймання Альдегиды
Альдегиды Детский стиральный порошок «Ушастый нянь»
Детский стиральный порошок «Ушастый нянь» Застосування вуглеводів. Їх біологічна роль
Застосування вуглеводів. Їх біологічна роль Особый вид стекла хрусталь
Особый вид стекла хрусталь Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий
Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий Строение атома
Строение атома Химическая кинетика
Химическая кинетика Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В.
Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В. Карбон Карбон (С) або вуглець — хімічний елемент з атомним номером 6. Позначається С, належить до поширених елементів земної кор
Карбон Карбон (С) або вуглець — хімічний елемент з атомним номером 6. Позначається С, належить до поширених елементів земної кор Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації
Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації Презентация по Химии "Cинтетичні волокна" - скачать смотреть бесплатно
Презентация по Химии "Cинтетичні волокна" - скачать смотреть бесплатно Метаболизм - обмен веществ
Метаболизм - обмен веществ Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян
Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян Медь. Положение в периодической системе
Медь. Положение в периодической системе Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Качественный анализ. Таблица растворимости соединений
Качественный анализ. Таблица растворимости соединений Химическое равновесие
Химическое равновесие Общая характеристика галогенов
Общая характеристика галогенов Горение. Подводный факел
Горение. Подводный факел ЕГЭ. Химия. Содержательный блок Химический элемент. Вопрос А1, А 2
ЕГЭ. Химия. Содержательный блок Химический элемент. Вопрос А1, А 2 Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов
Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами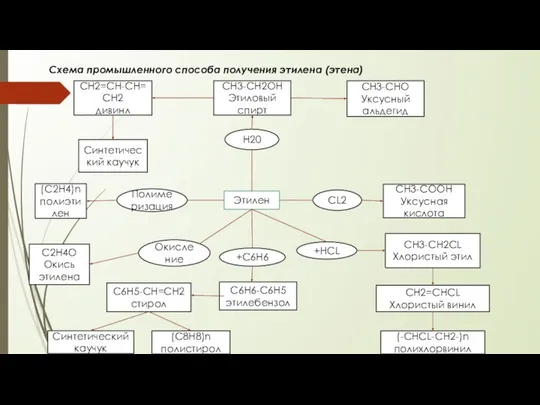 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена)