Содержание
- 2. Основні відомості: Основні відомості: Оксиди – це складні речовини, утворені двома елементами, одним з яких обов'язково
- 3. Еn Оm Еn Оm Де Е-елемент,n,m-валентність Формули оксидів:
- 4. Назви оксидів: Назви оксидів: Назва елементу + Валентність,якщо змінна + Слово “оксид”
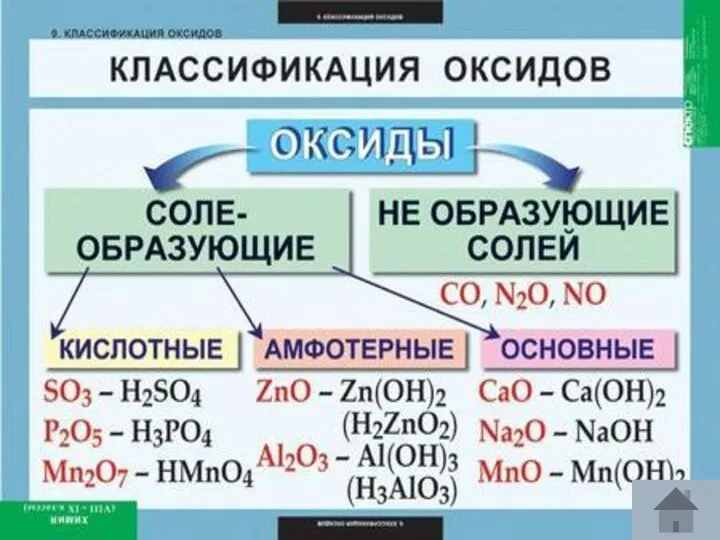
- 5. Класифікація: Класифікація: Са3(РО4)2,ZnSO4,Na2СО3 Класифікація:
- 6. Виділяють декілька основних фізичних властивостей оксидів: 1) Всі основні й амфотерні оксиди не мають запаху; 2)
- 7. оксид алюмінію оксид хрому оксид купруму оксид цинку
- 8. Хімічні властивості основних оксидів: Хімічні властивості основних оксидів: 1.Взаємодія з водою Основний оксид+вода=основа 2.Взаємодія з кислотою
- 9. Хімічні властивості кислотних оксидів: Хімічні властивості кислотних оксидів: 1.Взаємодія з водою Кислотний оксид+вода=кислота 2.Взаємодія з основами
- 10. Добування: Добування: Оксиди можна одержувати різними способами. Безпосереднім сполученням елементів з киснем: 2 Zn + O2
- 11. Використання: Використання: Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому? Наприклад, така добре
- 12. Для отримання скла складають шихту-суміш соди Na2CO3 (іноді сульфату натрію з вугіллям), вапняку CaCO3, кварцового піску,
- 14. Скачать презентацию










 Презентация Стекло, история открытия
Презентация Стекло, история открытия Радиоспектроскопические методы исследования, часть 1
Радиоспектроскопические методы исследования, часть 1 Пример практического тура. Всероссийская олимпиада школьников по химии
Пример практического тура. Всероссийская олимпиада школьников по химии Коррозия металлов
Коррозия металлов Структура и содержание КИМ-22
Структура и содержание КИМ-22 Глинистые породы
Глинистые породы №8 зертханалық жұмыс. Байланыстын каныпагандыгына сапалык реакция
№8 зертханалық жұмыс. Байланыстын каныпагандыгына сапалык реакция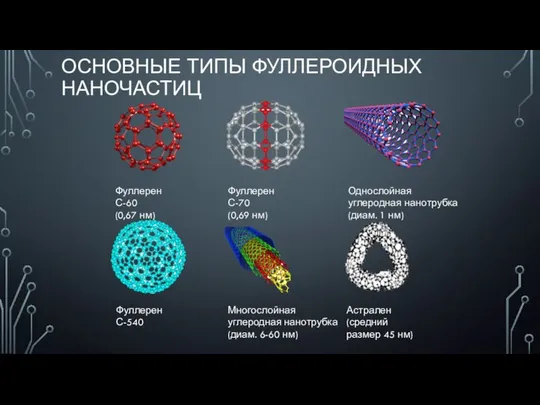 Основные типы фуллероидных наночастиц
Основные типы фуллероидных наночастиц Хлор
Хлор Бумага - важнейший элемент человеческой культуры, основа просвещения и воспитания человека.
Бумага - важнейший элемент человеческой культуры, основа просвещения и воспитания человека.  Викторина на тему: «Щелочные и щелочноземельные металлы в гомеопатии»
Викторина на тему: «Щелочные и щелочноземельные металлы в гомеопатии» Природный газ
Природный газ Классификация, хранение, маркировка химических реактивов. Вспомогательные материалы и растворы
Классификация, хранение, маркировка химических реактивов. Вспомогательные материалы и растворы Строение атома
Строение атома Оксиды неметаллов и металлов
Оксиды неметаллов и металлов Общая жесткость воды. Ионный обмен
Общая жесткость воды. Ионный обмен Цель и задачи дисциплины. Значение биохимии. (Тема 1)
Цель и задачи дисциплины. Значение биохимии. (Тема 1) Электропроводность растворов электролитов. Числа переноса
Электропроводность растворов электролитов. Числа переноса Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней.
Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней. Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Аминокислоты. Международная номенклатура АК
Аминокислоты. Международная номенклатура АК Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8)
Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8)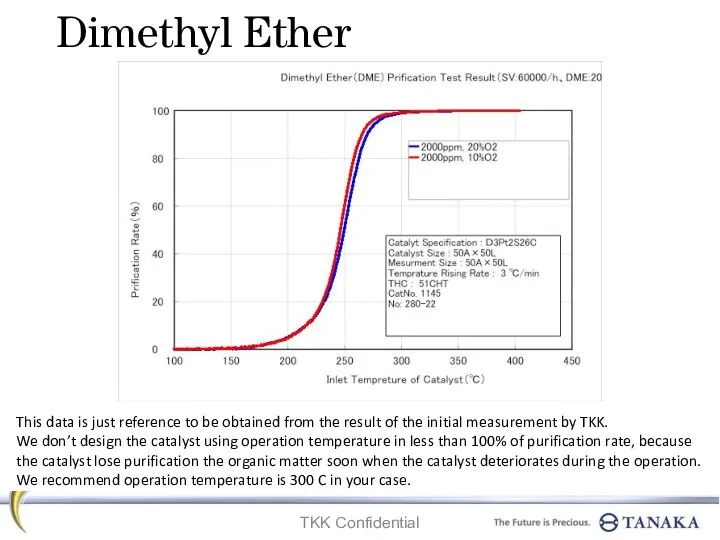 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Сколько нужно чистого белка
Сколько нужно чистого белка Комплексные соединения
Комплексные соединения Растворы
Растворы Интернет-тренажеры
Интернет-тренажеры Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010
Яблочная кладовая Автор работы: Быстрова Анастасия, ученица 9«А» класса Руководитель: Баранова Алевтина Владимировна 2010