Содержание
- 2. АВТОРЫ РАБОТЫ: ученица 11а класса ГБОУ школы № 880 – Мустафаева Диана учитель химии ГБОУ школы
- 3. Характеристика кислоты Получение Химические свойства Соли Применение ВЫВОД Серная кислота в природе С О Д Е
- 4. По основности: двухосновная По наличию кислорода: кислородосодержащая По силе: сильный электролит Это тяжёлая жидкость, которая в
- 5. Агрегатное состояние – жидкость Тяжелая маслянистая жидкость ("купоросное масло», ее плотность - r = 1,84 г/см3
- 6. Все, что по серной кислоте узнал – Запомни – это важно, Чтоб пользоваться ей Было бы
- 7. Химические свойства H2SO4 С металлами (в ряду активности металлов до водорода): H2SO4+Zn=ZnSO4 + H2 2. С
- 8. ОСОБОЕ СВОЙСТВО КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ – ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ При взаимодействии концентрированной серной кислоты с металлами
- 9. Автоцистерна для перевозки серной кислоты
- 10. Соли H2SO4 Они могут быть как растворимыми, так и нерастворимыми Химические свойства сульфатов: 1. С металлами
- 11. В природе встречается 180 минералов сульфатов, и на их долю приходится ~0,5 % массы земной коры.
- 12. Сульфат кальция Сульфат бария В Мексике не так давно обнаружили пещеру с 15-метровыми кристаллами гипса! 2Н2О)
- 13. Применение H2SO4 1. В производстве минеральных удобрений 2. Как электролит в свинцовых аккумуляторах 3. Для получения
- 14. Промышленное получение H2SO4 S SO2 SO3 H2SO4 S+O2=SO2 2SO2+O2=2SO3 SO3+H2O=H2SO4
- 15. Серная кислота в природе Кислые озёра
- 16. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения, произошедшего незаметно для людей. Тот,
- 17. Озеро шириной 500 м и глубиной 140 м состоит из прогретого до 40 градусов раствора серной
- 18. Серная кислота – очень активная жидкость, особенно концентрированная, которая реагирует со многими неорганическими веществами, также она
- 19. Нет кислоты, которая была бы нужнее и применялась бы чаще, чем серная. Главным образом, ее применяют
- 20. Ссылки на источники: 1.1.http://www.sigmatec.ru/main/prod/sernaya_kislota/nature 2. http://dobavkam.net/dobavki/e513 3. Учебник для общеобразовательных учреждений – 9 класс, О.С.Габриелян 4.
- 22. Скачать презентацию



















 Гиалурон қышқылы
Гиалурон қышқылы Растворы ВМС и их свойства
Растворы ВМС и их свойства Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско Растворы и их классификация
Растворы и их классификация Уксусная кислота
Уксусная кислота Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Производные пурина
Производные пурина Роль химии в жизни человека
Роль химии в жизни человека Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15
Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15 Основные понятия и законы химии
Основные понятия и законы химии Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Закон сохранения массы веществ
Закон сохранения массы веществ Производные ненасыщенных полиокси-γ-лактонов
Производные ненасыщенных полиокси-γ-лактонов Строение атома
Строение атома Классификация витаминов. Витаминоподобные соединения
Классификация витаминов. Витаминоподобные соединения Великие русские химики
Великие русские химики Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче
Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче Физические и химические явления
Физические и химические явления Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты
Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты Хлориди.
Хлориди. Хром. Использование хрома
Хром. Использование хрома Углеводы
Углеводы МЕТАЛЛЫ диктант 9 класс
МЕТАЛЛЫ диктант 9 класс 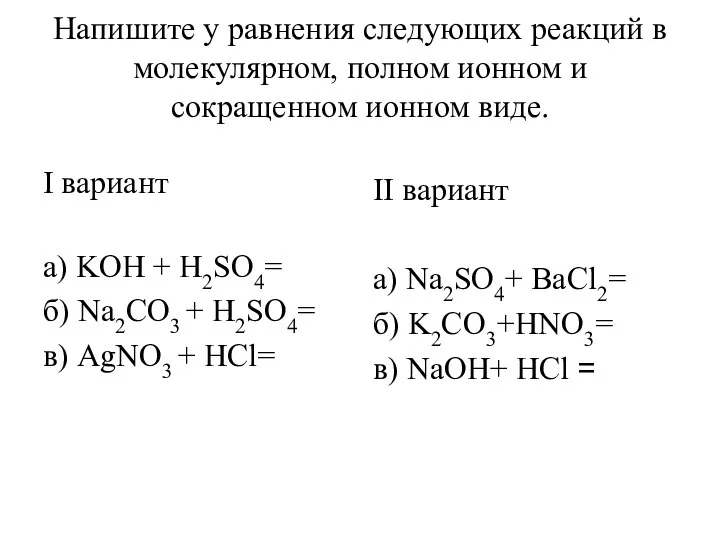 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Окислительновосстановительные реакции
Окислительновосстановительные реакции Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Алкены
Алкены